Se ferme
- 1520
- 65
- Raphaël Meyer
Nous expliquons quels sont les alcanes, leurs propriétés, la nomenclature, les types et donnent plusieurs exemples
Quels sont les alcanes?
Les Se ferme sont les composés organiques les plus simples qui existent. Ce sont des hydrocarbures aliphatiques saturés, formés exclusivement par le carbone et l'hydrogène, dans lesquels les carbones ne sont unis que par des liaisons covalentes simples simples.
Ils peuvent être une chaîne ouverte, auquel cas ils ont la formule générale CnH2n + 2. Ils peuvent également former un ou plusieurs cycles, auquel cas la formule générale perd deux hydrogènes pour chaque cycle formé (CnH2n S'ils ont un seul cycle, CnH2n-2 S'ils en ont 2, etc.).
De nombreux composés organiques courants que nous utilisons tous les jours sont atteints. Par exemple, le gaz de cuisine et le gaz naturel sont formés par un ou plusieurs alcanes gazeux. Le carburant pour les voitures (essence, benzine ou carburant, selon le pays) est composé de mélanges complexes d'alcanes liquides, parmi lesquels les plus importants sont les isomères de l'octane.
Propriétés d'Alcean
Ils sont très peu réactifs
La principale caractéristique ou la propriété chimique des alcanes est que ce sont des molécules assez stables qui ne participent pas à des réactions chimiques, à moins qu'elle ne soit dans des conditions très énergiques telles que des températures très élevées ou en présence de lumière ultraviolette ou de radicaux libres ou de radicaux libres.
Ce sont des composés apolaires
Les liens simples C-C et C sont des liaisons covalentes apolaires, donc les molécules alcanes ne peuvent pas avoir un moment dipolaire net. À cause de cela, ce sont des molécules apolaires.
Ils ont de faibles points d'ébullition et de fusion
En raison du même fait d'être apolar. Comme ces forces sont très faibles, elles sont faciles à casser pour fabriquer des solides en liquides et ces gaz à basse température.
Ils sont moins denses que l'eau
Les alcanes sont les moins denses des composés organiques, et ils sont toujours moins denses que l'eau. Pour cette raison, ils flottent toujours à la surface de l'eau lorsque les deux sont mélangés.
En général, ils sont incolores
Les alcanes gazeux et liquides sont incolores et translucides. Cependant, lorsqu'ils se sont solidifiés, ils forment des solides amorphes opaques blancs, comme dans le cas de certaines paraffines et des plastiques.
Ils ne sont pas solubles dans l'eau
La règle d'or pour la solubilité est que la dissolution similaire. L'eau est un solvant polaire tandis que tous les alcanes sont complètement apolaires, ils ne sont donc pas solubles dans l'eau.
Peut vous servir: diastréomèresIls sont solubles dans les solvants organiques apolaires
En utilisant le même argument précédent, les alcanes sont solubles dans des solvants apolaires tels que le benzène ou le cyclohexan. En fait, les alcanes liquides font partie des solvants organiques apolaires.
Ils ne peuvent pas subir de réactions d'addition
Étant des hydrocarbures saturés, les alcanes ne peuvent pas subir de réactions d'addition. La seule exception est le cyclopropane qui a un anneau de seulement trois membres qui est très tendre et peut être facilement brisé.
Ce sont des carburants
L'une des rares réactions chimiques dans lesquelles les alcanes participent est à la combustion, et c'est précisément l'utilisation principale qui leur est donnée.
Types d'alcanes
Selon la connectivité entre les atomes de carbone, les alcanes peuvent être:
- Linéaire
- Ramifié
- Cyclique (cycloalcanos)
- Toces bicyl ou polycycliques
- Spiranos
Alcanes linéaires
Ils sont les plus simples des alcanes et, par conséquent, de tous les composés organiques. Tous ont la formule moléculaire CnH2n + 2 Et ils sont caractérisés par une seule chaîne d'atomes de carbone liés les uns aux autres après l'autre.
Alcanes ramifiés
Ils ont également la formule générale CnH2n + 2 Mais contrairement aux alcanes linéaires, la chaîne d'atomes de carbone est ramifiée au moins à un moment donné. Les alcanes ramifiés sont des isomères de chaîne d'alcanes linéaires, car ils ne diffèrent que dans l'ordre dans lequel les atomes de carbone sont liés.
Cycloalcanos
Dans les cycloalcanos, les extrémités de la chaîne d'alcanes linéaires sont réunies pour former une chaîne cyclique. Pour former cette liaison C-C supplémentaire, il est nécessaire d'éliminer un hydrogène de chaque carbone terminal, de sorte que la formule générale de ces composés est CnH2n. Le plus petit cycle possible est celui de trois atomes de carbone appelés cyclopropane (c3H6).
Comme les alcanes de la chaîne ouverte qui peuvent avoir des ramifications, le cycloalcan peut également présenter des groupes de substituants sous forme de chaînes ouvertes.
Toces bicyl et polycycliques
Il existe de nombreux toums cycliques dans lesquels deux cycles ou plus partagent deux atomes de carbone ou plus. Ces composés sont appelés policiers. La formule moléculaire de la police dépend du nombre de cycles de la structure.
Dans le cas le plus simple, les vélos, la formule est CnH2n-2 Puisque quelques hydrogènes doivent être perdus pour fermer chaque cycle. Pour la police avec plus de deux cycles fusionnés, la formule sera égale à celle des alcanes moins une paire d'hydrogènes pour chaque cycle formé.
Peut vous servir: hydraceSpiranos
Les spiraniales sont une classe spéciale de vélos dans lesquels les deux cycles ne partagent qu'un seul atome de carbone. Dans ces cas, les deux cycles sont dans des plans perpendiculaires l'un de l'autre, donc la structure est vue comme si l'un des cycles était tourné par rapport à l'autre.
Nomenclature des alcanes
Nomenclature des alcanes linéaires
La nomenclature des alcanes et, en fait, celle de tous les composés organiques, est basée sur la nomenclature des alcanes linéaires. Ceux-ci sont simplement nommés selon le nombre d'atomes de carbone dans la chaîne.
Les quatre premiers reçoivent des noms communs qui sont du méthane, Ethan.) Jusqu'à la fin d'Alcano.
Nombre de carbones | Formule moléculaire | Formule semi-développée | nom |
1 | Ch4 | Ch4 | Méthane |
2 | C2H6 | Ch3ch3 | Etano |
3 | C3H8 | Ch3ch2ch3 | Propane |
4 | C4H10 | CH3 (CH2) 2CH3 | Butane |
5 | C5H12 | CH3 (CH2) 3CH3 | Pentano |
6 | C6H14 | CH3 (CH2) 4CH3 | Hexane |
7 | C7H16 | CH3 (CH2) 5CH3 | Heptano |
8 | C8H18 | CH3 (CH2) 6CH3 | Octane |
9 | C9H20 | CH3 (CH2) 7CH3 | Inano |
dix | C10H22 | CH3 (CH2) 8CH3 | doyen |
Nomenclature des alcaux ramifiés
Les alcanes ramifiés sont nommés sur le nom des alcanes linéaires. Le processus consiste à sélectionner l'une des chaînes de carbone possibles telles que la chaîne principale et le reste des ramifications restent en tant que groupes substituants.
Le processus se compose des étapes suivantes:
Étape 1: Identifiez la chaîne principale.
La sélection est effectuée selon les critères suivants par ordre de priorité:
- La chaîne la plus longue est sélectionnée.
- S'il y en a plus d'un, les plus ramifications sont sélectionnées chez eux.
- En cas de plusieurs qui a la même longueur et le même nombre de ramifications, celle qui, lors de la numérotation, donne la plus petite combinaison de localisateurs possible.
- Si deux chaînes ou plus ont la même longueur, le même nombre de ramifications et tous ont les mêmes localisateurs, ceux qui attribuent les localisateurs des mineurs aux ramifications qui apparaissent en premier dans l'ordre alphabétique sont sélectionnés.
- Dans le cas où tout ce qui précède est le même, alors n'importe qui peut être choisi.
La chaîne principale donne le nom principal à l'alcane, comme s'il s'agissait d'un alcane linéaire.
Il peut vous servir: nitrite de potassium (KNO2): structure, propriétés et utilisationsÉtape 2: Numéro de la chaîne principale.
Les atomes de carbone de la chaîne principale en séquence d'une extrémité à un autre doivent être répertoriés, en suivant ces règles:
- La numérotation attribuée par la combinaison la plus basse de localisateurs aux ramifications est sélectionnée.
- Si les deux nombres donnent la même combinaison de localisateurs, il est sélectionné celui qui a été attribué par les localisateurs des mineurs aux ramifications qui apparaissent d'abord dans l'ordre alphabétique.
- Dans le cas où les deux sont les mêmes, alors peu importe lequel est choisi.
Étape 3: Nommez les ramifications et commandez-les par ordre alphabétique.
Les ramifications sont nommées radicales, remplaçant le _ano de l'alcane linéaire correspondant par l'extrémité _ilo.
Nombre de carbones | Alkyle radical | nom |
1 | -Ch3 | Méthyle radical |
2 | -Ch2ch3 | "Éthyle |
3 | -Ch2ch2ch3 | "Propy |
4 | -CH2 (CH2) 2CH3 | "Butyl |
5 | -CH2 (CH2) 3CH3 | "Pentilo |
6 | -CH2 (CH2) 4CH3 | "Hexilo |
7 | -CH2 (CH2) 5CH3 | "Heptyl |
8 | -CH2 (CH2) 6CH3 | "Octilo |
9 | -CH2 (CH2) 7CH3 | "Nonilo |
dix | -CH2 (CH2) 8CH3 | "Decel |
Étape 4: Le nom du composé est construit.
Le nom est construit en nommant toutes les ramifications dans l'ordre alphabétique (supprimant la dernière lettre «O» du loyer), précédée par son localisateur, suivie du nom de la chaîne principale.
Si une branche est répétée, les localisateurs de chacun sont placés, séparés par des virgules, et mettent le préfixe qui indique comment il est répété pour 2, tri pour 3, etc.) est précédé par la branche, etc.).
Exemple:
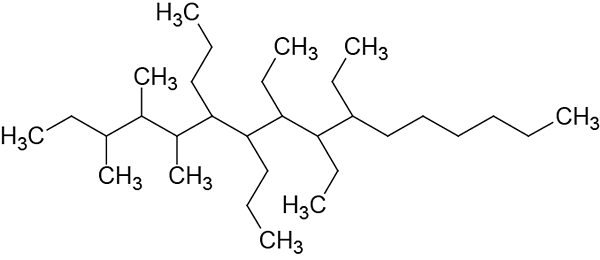
Nommez l'alcane ramifié suivant:

Étape 1: sélection de la chaîne principale.
Cette chaîne a 16 carbones, donc la chaîne principale sera appelée Hexadécano.
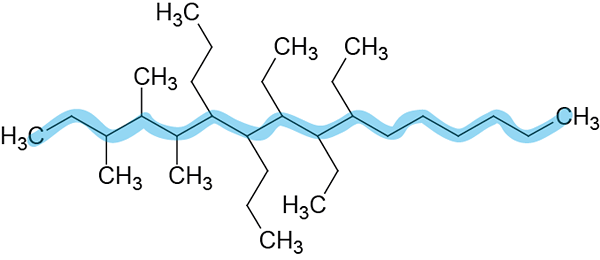
Étape 2: Numéro de chaîne principale.
Il est numéroté de gauche à droite car ils donnent aux localisateurs mineurs.
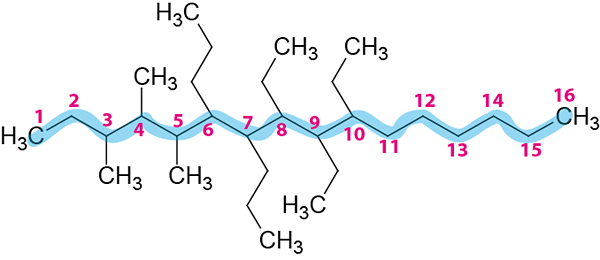
Étape 3: Nommez toutes les ramifications.
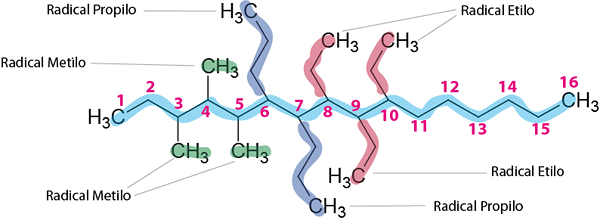
Il y a trois radicaux éthyliques, trois radicaux méthyle et deux radicaux propyles.
Étape 4: construire le nom
Le nom du composé sera:
8,9,10-trietil-3,4,5-triméthyl-6.7-dipropilhexadécano
Exemples d'alcanes
Dans le tableau suivant, quelques exemples supplémentaires d'alcanes sont présentés.
nom | Formule ou structure moléculaire | Radical | Nombre de carbones |
Méthane | Ch4 | Méthyle | 1 |
Etano | C2H6 | Éthyle | 2 |
Propane | C3H8 | N-propul | 3 |
N-butane | C4H10 | Blight N | 4 |
Isobutane | C4H10 | Isobutil | 4 |
N-pentane | C5H12 | N-pentile | 5 |
Isopentano | C5H12 | Isopeentile | 5 |
Néopentano | C5H12 | Néopentil | 5 |
N-hexane | C6H14 | N-hexyle | 6 |
Polyéthylène | CH3 (CH2) NCH3 | ---- | > 100 |
Cyclopentano | C5H10 | Cyclopentil | 5 |
Cyclohexan | C6H12 | Cyclohexil | 5 |

