Baird Parker Agar ce qui est, fondation, préparation, utilisation
- 3948
- 33
- Mlle Ambre Dumont
Il Baird Parker Agar ou l'agar à jaune d'oeuf est un milieu de culture solide, sélectif et différentiel. Il a été créé en 1962 pour la détection et le nombre de staphylocoques de coagulase positive (Staphylococcus aureus).
Il est composé de caséine pancréatique hydrolysée, d'extrait de viande, d'extrait de levure, de chlorure de lithium, de glycine, de pyruvate de sodium, de télélurite de potassium, d'adhérence et d'émulsion de jaune d'oeuf.
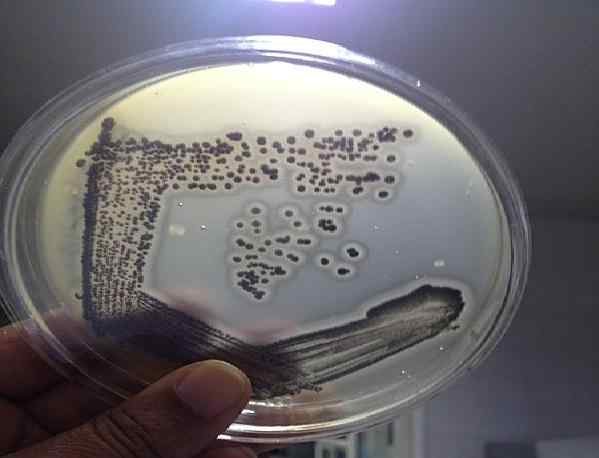
 Colonies typiques de Staphylococcus aureus dans le vieillissement de Baird Parker. Source: Daizy John [CC par 4.0 (https: // CreativeCommons.Org / licences / par / 4.0)]
Colonies typiques de Staphylococcus aureus dans le vieillissement de Baird Parker. Source: Daizy John [CC par 4.0 (https: // CreativeCommons.Org / licences / par / 4.0)] L'agar Baird Parker est basée sur la capacité de la S. aureus pour réduire la télélurito et produire la lécithinase. Les deux propriétés génèrent une colonie avec des caractéristiques spécifiques pour cette espèce. Par conséquent, il offre une grande efficacité dans la détection de ce micro-organisme.
Les colonies typiques de S. aureus Ils sont noirs ou gris foncé, avec un bord incolore et un halo clair qui les entoure, se différenciant du reste des micro-organismes. Ce pathogène peut être trouvé dans des échantillons cliniques, des eaux, des cosmétiques et des aliments crus ou cuits.
Son diagnostic ou sa détection est de la plus haute importance, en raison de la variété des pathologies qu'elle produit, telles que l'intoxication alimentaire, le syndrome de la peau à l'échelle, le syndrome de choc toxique, les abcès, la méningite, la septicémie, l'endocardite, entre autres.
Base
Pouvoir nutritionnel
La caséine hydrolysée pancréatique, l'extrait de viande et l'extrait de levure sont les sources de nutriments, de vitamines et de minéraux nécessaires au développement microbien général, tandis que le pyruvate et la glycine sont des composés qui favorisent la croissance spécifique de Staphylococcus aureus.
Sélectif
L'agar Baird Parker est sélective car elle contient des substances qui inhibent la croissance de la flore qui l'accompagne, tout en favorisant le développement de S. aureus. Les composés inhibiteurs sont le chlorure de lithium et le tellurite de potassium.
Différentiel
Ce milieu permet de différencier le S. aureus du reste des staphylocoques coagulases négatives. S. aureus Il a la capacité de réduire la télélurite en télécolaire métallique noire, formant des colonies noires ou gris foncées.
De même, le jaune d'oeuf fournit les substrats pour démontrer la présence de la lectinase et de l'enzyme Lipasa. S. aureus C'est une lécithinase positive et donc un halo clair sera observé autour de la colonie, indiquant que la lécithine a été hydrolysée.
Peut vous servir: Respiration branchée: comment cela se fait et des exemplesEn ce sens, l'apparition dans ce côlon noir ou brillant noir ou gris-gris S. aureus.
Si une zone de précipitation est formée, il est indicatif qu'il existe une activité de la lipase. Quelques souches de S. aureus Ils sont positifs et autres lipase négative.
Dans le cas où le S. aureus Être une lipase positive, une zone opaque sera observée autour de la colonie noire ou gris foncé, puis le halo clair pour l'action de la lécithinase.
Les colonies de bactéries autres que S. aureus Capable de grandir dans ce médium, ils développeront des colonies incolores ou brunes, sans halo autour.
Vous pouvez également observer les colonies noires atypiques avec ou sans bord incolore, mais sans halo léger. Ces colonies ne doivent pas être prises en compte, elles ne correspondent pas à S. aureus.
préparation
Émulsion de jaune d'oeuf
Un œuf de poulet frais est pris, se promenait bien et placé 2 à 3 heures dans 70% d'alcool. Ensuite, l'œuf s'ouvre aseptiquement et soigneusement sépare le brillant du jaune. Par la suite, 50 ml de jaune sont pris et mélangés avec 50 ml de solution physiologique stérile.
1% P / V Teltto en potassium
Certaines maisons commerciales vendent 1% Poetassium teluro prêt à l'emploi. Il est ajouté au milieu avant que les moyens se solidifie.
Pour préparer cette solution en laboratoire, 1.0 gr de la tellurite de potassium et se dissout dans une partie de l'eau. Par la suite, la quantité d'eau est terminée jusqu'à ce qu'elle atteigne 100 ml. La solution doit être stérilisée par la méthode de filtration.
Préparation du milieu de culture
Peser 60 gr de milieu déshydraté et se dissoudre dans 940 ml d'eau distillée. Laissez le mélange de repos pendant environ 10 à 10 minutes.
Il peut vous servir: relations interspécifiques: types et exemplesAppliquer la chaleur en remuant fréquemment l'environnement pour améliorer le processus de dissolution. Laisser bouillir une minute. Stérilice en autoclave à 121 ° C pendant 15 minutes.
Laisser reposer jusqu'à ce qu'il atteigne une température de 45 ° C et ajouter 50 ml d'émulsion de jaune d'oeuf et 10 ml de 1%. Bien mélanger et servir entre 15 et 20 ml sur des assiettes stériles de Pétri.
Laisser solidifier, commander dans un inversé dans les plaqueurs et économiser au réfrigérateur jusqu'à utiliser.
Le pH final du milieu préparé doit être de 6,8 ± 0,2.
Avant de semer un échantillon, vous devez attendre que la plaque prenne la température de l'environnement. Semez les plaques en raison de l'attaque ou de la surface plantée avec des spatules Drigalski.
La couleur du milieu déshydraté est rôtie et la couleur du milieu préparé est ambre clair.
Utiliser
Échantillons cliniques
Les échantillons cliniques sont directement semés en déchargeant une partie du matériau à une extrémité de l'assiette, et à partir de là, ils se sont démarqués à cause de l'épuisement. Incuber pendant 24 à 48 heures à 35-37 ° C.
Échantillons de nourriture
Peser 10 GR de l'échantillon alimentaire et homogénéisation dans 90 ml d'eau de peptonada à 0,1%, à partir de là, ils préparent des dilutions si nécessaire. Inoculer les plaques en triple avec 0,3 ml des solutions préparées et semer par surface avec spatule Drigalski. Il est incuba pendant 24 à 48 heures à 35-37 ° C.
Cette méthodologie vous permet de compter les colonies typiques obtenues et est idéale lorsque la présence de S. aureus au-dessus de 10 UFC par échantillon GR / ML.
S'il est soupçonné que le montant de S. aureus Il est petit ou il y a beaucoup de flore qui l'accompagne, il est suggéré. Cela favorisera la croissance de S. aureus et inhiber le développement de la flore qui l'accompagne. Les tubes de la touffe seront semés dans Baird Parker Agar.
Peut vous servir: comment les organismes vivants de notre environnement sont-ils distingués?Échantillons d'eau
Dans un système de filtration sous vide et stérilisé, 100 ml d'eau à l'étude sont filtrés, puis la membrane microporeuse de 0,4 microns est retirée avec une pince stérile et placée sur une plaque Baird Parker. Il est incuba pendant 24 à 48 heures à 35-37 ° C. Cette technique permet aux colonies typiques de compter sur S. aureus.
Contrôle de qualité
Pour évaluer la qualité de l'agar Baird Parker, des souches connues peuvent être utilisées, telles que Staphylococcus aureus ATCC 25923, Staphylococcus aureus ATCC 6538, Staphylococcus epidermidis ATCC 12228, Escherichia coli ATCC 25922 O Proteus mirabilis ATCC 43071.
Dans le cas de souches de S. aureus L'ATCC est connu pour réduire la télélurite, et ils sont une lipase positive et une lécithinase. Par conséquent, il doit y avoir un développement satisfaisant et cultiver des colonies convexes avec un centre noir et un bord incolore, avec un halo opaque et un autre halo plus externe clair.
Pour sa part, de S. épidermidis Un mauvais développement est attendu dans ce milieu, avec des colonies grises amarrées au noir, sans halo clair.
Pour ET. coli et P. Mirabilis Il devrait être totalement ou partiellement inhibé. En cas de croissance des colonies brunes sans zone opaque, ou halo clair.
recommandations
-Le milieu ne doit pas être chauffé après avoir ajouté le jaune et le jaune d'oeuf.
-La préparation de l'émulsion du jaune d'oeuf et de son agrégat au milieu est une étape de contamination très vulnérable. Il faut se soucier de.
-S'il y a une présence de colonies typiques de S. aureus Il doit être corroboré en faisant un test de coagulase à cette souche.
-S'il y a des résultats douteux avec la coagulase, d'autres tests de confirmation doivent être montés.
-Veillez à ne pas confondre la présence de colonies typiques de S. aureus Avec les colonies noires atypiques.
Les références
- Laboratoires BD. Baird Parker Agar. Disponible sur: BD.com
- Laboratoires Francisco Soria Melguizo. Baird Parker Agar. Disponible sur: http: // f-Soria.C'est / informatique

