Structure d'acétate de sodium, propriétés, synthèse, utilisations

- 2719
- 67
- Mlle Ambre Dumont
Il l'acétate de sodium C'est un sel de sodium d'acide acétique dont la formule moléculaire est C2H3SOIT2N / A. Il se compose d'une poudre blanche délicate, présente essentiellement sous deux formes: anhydre et trihydrate. Les deux sont très solubles dans l'eau, le solvant universel; Mais pas si soluble dans les alcools ou l'acétone.
La forme anhydrate a une densité, une fusion et un point d'ébullition avec des valeurs plus élevées que celles présentées par la forme trihydrate d'acétate de sodium. En effet+ et ch3Roucouler-.
 Aspect en acétate de sodium
Aspect en acétate de sodium L'acétate de sodium est stable, surtout s'il est stocké entre 2 et 8 ºC; Mais il est sensible à l'action de forts agents oxydants et halogènes.
Il peut être préparé par la réaction du bicarbonate de sodium avec de l'acide acétique. Aussi, avec la réaction de l'acide acétique avec l'hydroxyde de sodium. Les deux réactions sont simples à élaborer et à faible coût économique; Le premier peut même être fait à la maison.
Ce sel est un peu toxique. Produit une irritation de la peau, seulement après un contact fréquent et continu. C'est peu irritant pour les yeux mais peut irriter les voies respiratoires. Il n'y a aucune information sur un effet nocif de votre ingestion.
Il a de nombreuses utilisations et applications, mettant en évidence sa fonction d'amortissement de pH, avec l'acide acétique. L'amortisseur d'acétate a un PKA = 4,7; ce qui confère une grande efficacité dans la régulation du pH dans un environnement acide avec des valeurs de pH entre 3 et 6.
En raison de sa faible toxicité et de ses propriétés, il a été largement utilisé pour améliorer le goût des aliments, ainsi qu'un agent qui offre une protection contre leur décomposition en raison de leur action contre les microbes.
[TOC]
Structure d'acétate de sodium
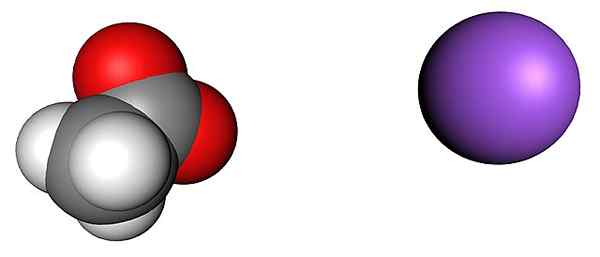 Acétate et ions sodium. Source: Shu0309 [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]
Acétate et ions sodium. Source: Shu0309 [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] L'image supérieure montre les ions qui constituent les cristaux anhydre en acétate de sodium (sans eau). La sphère violette correspond à la na cation+, Et l'ion moléculaire à sa gauche est l'acétate, Cho3Roucouler-, Avec ses atomes d'oxygène représentés par les sphères rouges.
Ces pairs, selon le Chip Ch3Chemin, sont dans une proportion 1: 1; Pour chaque cho3Roucouler-, Il doit y avoir un na cation+ attiré par sa charge négative et vice versa. Ainsi, les attractions entre eux et les répulsions entre des charges égales finissent par établir des modèles structurels qui définissent un cristal, dont l'expression minimale est la cellule unitaire.
Cette cellule unitaire, comme le verre dans son ensemble, varie en fonction de la disposition des ions dans l'espace; Ce n'est pas toujours la même, même pour le même système cristallin. Par exemple, l'acétate de sodium anhydre peut former deux polymorphes ortorrombiques, dont l'un est représenté ci-dessous:
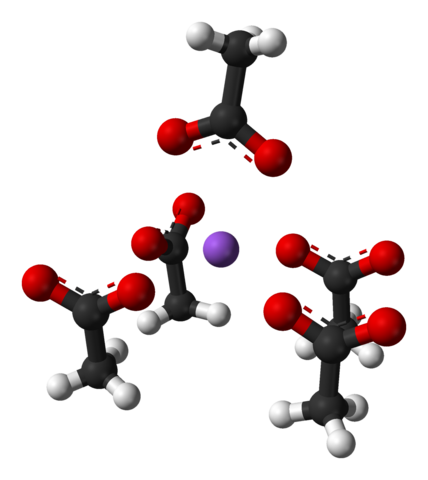 Cellule unitaire d'acétate de sodium cristaux orthorrombiques. Source: Benjah-Bmm27 [domaine public]
Cellule unitaire d'acétate de sodium cristaux orthorrombiques. Source: Benjah-Bmm27 [domaine public] Notez la disposition des ions: quatre ions Cho3Roucouler- Ils enferment un na+ De telle manière qu'ils "dessinent" une pyramide à base carrée déformée. Chacun de ces cho3Roucouler- à son tour interagir avec un autre na+ adjacent.
Cristaux hydratés
L'acétate de sodium a beaucoup d'affinité pour l'eau; En fait c'est délicieux, c'est-à-dire qu'il conserve l'humidité jusqu'à ce qu'il soit dissous dans le même. Plus l'humidité est grande, plus tôt elle "fond". C'est parce que tellement3Roucouler- Comme na+ Ils peuvent hydrater, s'entourer de molécules d'eau qui guident leurs dipôles vers leurs charges (Na+ Oh2, Ch3Roucouler- Hoh).
Peut vous servir: Silver Bromide (AGBR): structure, propriétés et utilisationsLorsque ce sel est préparé en laboratoire ou à la maison, c'est une telle affinité pour l'eau que même à des températures normales est déjà obtenue sous forme d'hydrate; le ch3Pata · 3h2SOIT. Leurs cristaux cessent d'être ortorrombiques et de devenir monocliniques, car ils incorporent maintenant trois molécules d'eau pour chaque paire Cho3Roucouler- et na+.
Propriétés
Des noms
-L'acétate de sodium.
-Éthanoate de sodium (IUPAC).
Masse molaire
-Anhydre: 82,03 g / mol.
-Trihydraté: 136,03 g / mol.
Aspect
Poudre blanche délicate.
Odeur
Au vinaigre quand il est chauffé pour décomposer.
Densité
-Anhidro: 1, 528 g / cm3 à 20 ºC.
-Trihydraté: 1,45 g / cm3 à 20 ºC.
Point de fusion
-Anhidro: 324 ºC (615 ºF, 597 K).
-Triohydrate: 58 ºC (136 ºF, 331 K).
Point d'ébullition
-Anhidro: 881,4 ºC (1.618,5 ºF, 1.154,5 k).
-Trihydrate: 122 ºC (252 ºF, 395 K). Il se décompose.
Solubilité
Dans l'eau
-Anhydro: 123,3 g / 100 ml à 20 ° C.
-Trihydraté: 46,4 g / 100 ml à 20 ºC.
En méthanol
16 g / 100 g à 15 ºC.
En éthanol
5,3 g / 100 ml (trihydrate).
En acétone
0,5 g / kg à 15 ° C.
Acidité
PKA: 24 (20 ºC).
Basicité
PKB: 9.25. Ici, il est évident que l'acétate de sodium est un sel de base pour avoir à avoir un PKB inférieur à son PKA.
Indice de réfraction (ηd)
1464
Capacité calorique
-100,83 J / mol · k (anhydre).
-229.9 J / mol · k (trihydrado).
point d'allumage
Plus de 250 ° C.
Température d'auto-signification
600 ºC.
pH
8,9 (solution 0,1 m à 25 ºC).
La stabilité
Écurie. Incompatible avec des agents forts et halogènes oxydants. Humidité.
Réactions
L'acétate de sodium peut former un ester en réagissant avec un halogénure de location; Par exemple, Bromoetano:
Ch3Poron + brch2Ch3 => Ch3COOCH2Ch3 + Nabr
L'acétate de sodium est décarboxyla pour former du méthane (pyrolyse) en présence de NaOH:
Ch3Poon + naoh => ch4 + N / A2CO3
La réaction est catalysée par les ventes de CESIO.
La synthèse
L'acétate de sodium peut être produit à faible coût en laboratoire en réagissant du bicarbonate de sodium avec de l'acide acétique:
Nahco3 + Ch3COOH => CH3Chemin + H2CO3
Cette réaction s'accompagne de la présence dans la solution d'une bulle intense, en raison de la décomposition de l'acide carbonique dans l'eau et le dioxyde de carbone.
H2CO3 => H2Ou + CO2
Industriellement, l'acétate de sodium est produit par réaction d'acide acétique avec l'hydroxyde de sodium.
Ch3COOH + NAOH => CH3Chemin + H2SOIT
Applications
Sacs thermiques
L'acétate de sodium est utilisé pour la fabrication de sacs thermiques.
Initialement, les cristaux de sel sont dissous dans un volume d'eau pour la préparation d'une solution qui devient sursaturée.
Ensuite, la solution d'une température supérieure à 58 ºC est chauffée, qui est son point de fusion. La solution sursaturée à température ambiante peut refroidir et la formation de cristaux n'est pas observée; La solution est terminée-chirp.
Peut vous servir: tableau périodique, à quoi sert-ilL'absence de cristaux s'explique que les molécules liquides sont trop désordonnées et n'ont pas de guidage pour atteindre la température de cristallisation. Le liquide est dans un état métastable, un état de déséquilibre.
Donner. Dans le cas des sacs thermiques, une fixation mécanique est pressée pour remuer le liquide et initier la formation de cristaux et la solidification de la solution de sodium trihydraté de sodium.
À mesure que la cristallisation se produit, la température augmente. Les cristaux à acétate de sodium trihydraté acquièrent l'apparence de la glace, mais ils sont chauds, donc il est appelé "glace chaude".
Industriels
-L'acétate de sodium est utilisé dans l'industrie textile comme mordant dans le processus de coloration des tissus
-Neutraliser les déchets d'acide sulfurique
-Il est utilisé dans le traitement du coton pour l'élaboration des cotons de coton, utilisable dans le nettoyage personnel et à des fins médicales
-Il est utilisé dans le décapage en métal, avant son chrome
-Collabore de sorte que la vulcanisation du chloroprène ne se produit pas dans le processus de production de caoutchouc synthétique
-Intervient dans la purification du glucose
-Il est utilisé dans le bronzage des peaux.
Usage médical
L'acétate de sodium fait partie des composés utilisés pour fournir des électrolytes administrés aux patients par voie intraveineuse.
Il est utilisé pour corriger les niveaux de sodium chez les patients hyponathémiques, également dans la correction de l'acidose métabolique et de l'alcalin d'urine.
Solution d'amortissement de pH
Il est utilisé comme régulateur de pH dans de nombreuses réactions enzymatiques qui se produisent entre pH 3 et pH 6.
Les différents pH de la solution de tampon d'acétate sont atteints par la variation de la concentration d'acide acétique et d'acétate de sodium.
Par exemple, pour obtenir un pH 4,5, la solution tampon a une concentration d'acide acétique de 3,8 g / L et une concentration d'acétate de sodium anhydre de 3,0 g / L.
La concentration de la solution de tampon d'acétate peut être augmentée, augmentant dans la même proportion les composants de la solution nécessaire pour obtenir le pH souhaité.
Agracheur d'acétate / acétonitrile est utilisé dans l'électrophorèse capillaire dans la séparation de la photbérance.
Laboratoires de recherche
-L'acétate de sodium est un agent nucléophile faible qui est utilisé dans la polymérisation anionique de la β-lactone.
-Il est utilisé comme réactif dans la résonance magnétique nucléaire des macromolécules biologiques.
-Il est utilisé dans l'extraction des cellules des cellules. Le sodium est un cation qui interagit avec les charges négatives de phosphates présents dans l'ADN, ce qui aide à sa condensation. En présence d'éthanol, l'ADN forme un précipité qui peut ensuite être séparé en la couche aqueuse.
Conservation des aliments
-Il aide à prévenir la croissance bactérienne, en plus de prévenir la génération d'acidité excessive qui provoque une détérioration des aliments, en maintenant un pH spécifique.
-Le sodium présent dans l'acétate améliore le goût des aliments.
-L'acétate de sodium est utilisé dans la préparation des cornichons de légumes: concombre, carotte, oignon, etc. De plus, il est utilisé dans la conservation de la viande.
Peut vous servir: diméthylanylin: structure, propriétés, synthèse, utilisationsConservation du béton
Le béton est endommagé par l'action de l'eau qui raccourcit sa durée. L'acétate de sodium agit comme un agent d'étanchéité en béton qui l'a imperméable à l'eau, prolongeant ses caractéristiques initiales.
Jeunes expériences
Expérience 1
Une expérience simple est la synthèse d'acétate de sodium par la réaction de bicarbonate de sodium avec le vinaigre (5% d'acide acétique).
30 ml de vinaigre sont placés dans un bécher et environ 3,5 g de bicarbonate sont ajoutés.
Dans la réaction, les formes de sodium et d'acide carbonique se forment. L'acide est décomposé en dioxyde de carbone et en eau. La génération de dioxyde de carbone produira une bulle intense dans la solution.
Pour collecter de l'acétate de sodium, l'évaporation de l'eau est causée, chauffant la solution.
Expérience 2
Une autre expérience simple est la formation d'acétate de trihydrate de sodium.
Pour ce faire, environ 20 g d'acétate de sodium trihydrate et placé dans un bécher, puis ajoutant 10 ml d'eau, puis ajoutant 10 ml d'eau. La solution est chauffée à une température supérieure à 58 ºC.
L'acétate de sodium est complètement dissous pour s'assurer que la solution est sursaturée. Auparavant, une capsule Pietri est placée sur une surface froide.
Le contenu du bécher avec de l'acétate de trihydrate dans la capsule de Pietri est lentement versé. La température liquide dans la capsule commence à descendre, même sous le point de fusion, sans observer la cristallisation ou la solidification de l'acétate de sodium trihydraté.
Habituellement, pour produire la cristallisation de l'acétate de sodium trihydraté, une petite quantité de sel est ajoutée pour servir de noyau de cristallisation. D'autres fois, il y a une petite perturbation de la solution pour initier la cristallisation de l'acétate de sodium.
Les cristaux à acétate de sodium trihydraté ressemblent à la glace, mais s'ils sont touchés, on remarquera qu'ils sont relativement chauds. Pour cette raison, le sel est appelé "glace chaude".
Toxicité
L'acétate de sodium est un très petit composé toxique. Il n'est pas non plus classé comme un sensibilisation à la peau et aux voies respiratoires.
De plus, l'acétate de sodium n'est pas classé comme agent mutagène dans les cellules germinales, cancérigènes ou toxiques pour la reproduction.
Bref, c'est peu irritant pour les yeux. Les voies respiratoires peuvent être irritées après leur inhalation. Un contact fréquent et constant avec la peau peut provoquer son irritation.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- WorldofChemicals. (16 janvier 2017). Comment préparer de l'acétate de sodium à la maison? Récupéré de: moyen.com
- Centre national d'information sur la biotechnologie. (2019). L'acétate de sodium. Base de données PubChem. CID = 517045. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- S. Cameron, k. M. Mannan et M. SOIT. Rahman. (1976). La structure cristalline de l'acétate de sodium trihydrate. Cryst ACT. B32, 87.
- Wikipédia. (2019). L'acétate de sodium. Récupéré de: dans.Wikipédia.org
- Helmestine, Anne Marie, Ph.D. (24 janvier 2019). Faire de la glace chaude à partir du vinaigre et du bicarbonate de soude. Récupéré de: Thoughtco.com
- Livre chimique. (2017). L'acétate de sodium. Récupéré de: Chemicalbook.com
- Wasserman Robin. (2019). Utilisations de l'acétate de sodium. Récupéré de: Livestrong.com
- Banc de drogue. (2019). L'acétate de sodium. Récupéré de: Drugbank.CA

