Absorbance ce qui est, des exemples et des exercices résolus
- 2522
- 669
- Adrien Remy
La absorbance C'est le logarithme avec un signe négatif du quotient entre l'intensité de la lumière émergente et l'intensité de l'incident de la lumière sur un échantillon de solution translucide qui a été illuminée avec. Ce quotient est le transmittance.
Le processus physique du passage de la lumière à travers un échantillon est appelé transmission lumineuse, Et l'absorbance en est une mesure. Par conséquent, l'absorbance devient le moins de logarithme de transmittance et est un fait important pour déterminer la concentration d'un échantillon qui est généralement dissous dans un solvant comme l'eau, l'alcool ou tout autre.
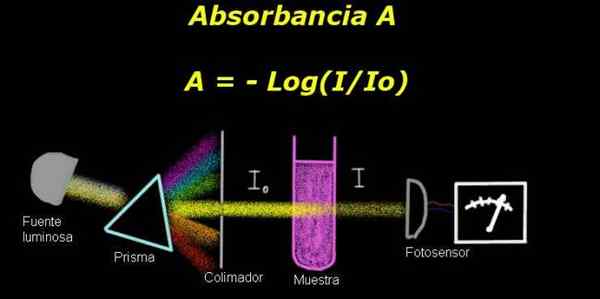
 Figure 1. Schéma du processus d'absorbance. Préparé par f. Zapata
Figure 1. Schéma du processus d'absorbance. Préparé par f. Zapata Pour mesurer l'absorbance, un appareil est requis Électro-photomètre, avec lequel un courant est mesuré qui est proportionnel à l'intensité lumineuse incident à sa surface.
Lors du calcul de la transmittance, le signal de l'intensité correspondant au solvant seul est généralement mesuré et ce résultat est enregistré comme Io.
Ensuite, l'échantillon dissous dans le solvant avec les mêmes conditions d'éclairage est placé. La mesure mesurée par l'électro-photomètre est désignée comme Toi, ce qui vous permet de calculer la transmittance T Selon la formule suivante:
T = i / isoit
C'est une quantité déclenchée. La Absorbance a Ceci est exprimé comme:
A = - log (t) = - log (i / isoit)
[TOC]
Absorbance molaire et absorbation
Les molécules qui composent un produit chimique sont capables d'absorber la lumière, et une mesure de ceci est une absorbance précisément. C'est le résultat de l'interaction entre les photons et les électrons moléculaires.
C'est donc une ampleur qui dépendra de la densité ou de la concentration des molécules qui composent l'échantillon ainsi que le chemin optique ou la distance parcourue par la lumière.
Vous pouvez vous servir: la troisième loi de Newton: applications, expériences et exercicesLes données expérimentales indiquent que l'absorbance POUR est linéairement proportionnel à la concentration C et la distance d Light a parcouru. Ainsi, pour le calculer en fonction de ces paramètres, la formule suivante peut être établie:
A = ε⋅c⋅d
Dans la formule précédente, ε C'est une constante de proportionnalité connue du nom de Molaire absorbant.
L'absorption molaire dépend du type de substance et de longueur d'onde avec laquelle l'absorbance est mesurée. La Molaire absorbant Il est également sensible à la température de l'échantillon et au pH du même.
Loi sur la bière-lambert
Cette relation entre l'absorbance, l'absorbité, la concentration et la distance de l'épaisseur du chemin que la lumière suit dans l'échantillon est connue sous le nom de loi de bière-Lambert.
 Figure 2. Droit de la bière - Lambert. Source: F. Zapata,
Figure 2. Droit de la bière - Lambert. Source: F. Zapata, Ci-dessous, il existe quelques exemples de comment l'utiliser.
Exemples
Exemple 1
Au cours d'une expérience, un échantillon avec une lumière rouge d'un laser d'hélium-neon, dont la longueur d'onde est de 633 nm. Un électro-fotomètre mesure 30 mV lorsque la lumière laser affecte directement et 10 mV lorsqu'il passe par un échantillon.
Dans ce cas, la transmittance est:
T = i / io = 10 mV / 30 mV = ⅓.
Et l'absorbance est:
A = - log (⅓) = log (3) = 0,48
Exemple 2
Si la même substance est placée dans un récipient qui a la moitié de l'épaisseur.
Il faut considérer que si l'épaisseur diminue à la moitié, alors l'absorbance proportionnelle à l'épaisseur optique diminue de moitié, c'est-à-dire A = 0,28. La transmittance des tonnes sera donnée par la relation suivante:
Peut vous servir: tir vertical: formules, équations, exemplesT = 10-a = 10 ^ (- 0.28) = 0,53
L'électro-fotomètre marquera 0,53 * 30 mV = 15,74 mV.
Exercices résolus
Exercice 1
Il est voulu déterminer l'absorbity molaire d'un certain composé breveté qui est en solution. Pour cela, la solution à la lumière d'une lampe de sodium de 589 nm est éclairée. L'échantillon sera placé sur 1,50 cm d'épaisseur.
Il est basé sur une solution de concentration de 4,00 × 10 ^ -4 moles par litre et la transmittance est mesurée, ce qui est mesuré en 0,06. Déterminer avec ces données l'absorbity molaire de l'échantillon.
Solution
En premier lieu, l'absorbance est déterminée, qui est définie comme la moins basée sur le logarithme dix de transmittance:
A = - log (t)
A = - log (0,06) = 1,22
Ensuite, la loi de Lambert-Beer est utilisée qui établit une relation entre l'absorbance, l'absorbation molaire, la concentration et la longueur optique:
A = ε⋅c⋅d
Effacer l'absorbity molaire La relation suivante est obtenue:
ε = a / (c⋅d)
Remplacement des valeurs données:
ε = 1,22 / (4,00 × 10 ^ -4 m⋅1,5 cm) = 2030 (m⋅cm) ^ - 1
Le résultat précédent a été arrondi à trois chiffres significatifs.
Exercice 2
Afin d'améliorer la précision et de déterminer l'erreur de la mesure de l'absorption molaire de l'échantillon dans l'exercice 1, l'échantillon est successivement dilué dans la moitié de la concentration et la transmittance est mesurée dans chaque cas.
À partir de CO = 4 × 10 ^ -4 m avec la transmittance t = 0,06 La séquence de données suivante pour la transmittance et l'absorbance calculées à partir de la transmittance est obtenue:
CO / 1-> 0,06-> 1,22
CO / 2-> 0,25-> 0,60
CO / 4-> 0,50-> 0,30
CO / 8-> 0,71-> 0,15
CO / 16-> 0,83-> 0,08
CO / 32-> 0,93-> 0,03
CO / 64-> 0,95-> 0,02
CO / 128-> 0,98-> 0,01
CO / 256-> 0,99-> 0,00
Avec ces données, faites:
Il peut vous servir: vagues stationnaires: formules, caractéristiques, types, exemplesa) un graphique d'absorbance basé sur la concentration.
b) un ajustement linéaire des données et trouver la pente.
c) De la pente obtenue, calculez l'absorbation molaire.
Solution
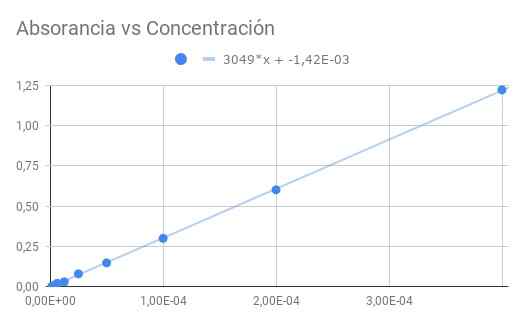 figure 3. Absorbance vs concentration. Source: F. Zapata.
figure 3. Absorbance vs concentration. Source: F. Zapata. La pente obtenue est le produit de l'absorganivité molaire par la distance optique, donc divisant la pente par une longueur de 1,5 cm, nous obtenons une molaire absorbant
ε = 3049 / 1,50 = 2033 (m⋅cm) ^ - 1
Exercice 3
Avec les données de l'exercice 2:
a) Calculez l'absorganivité pour chaque données.
b) Déterminer une valeur moyenne de l'absorbité molaire, son écart-type et l'erreur statistique associée à la moyenne.
Solution
L'absorption molaire est calculée pour chacune des concentrations testées. Rappelons que les conditions d'éclairage et la distance optique restent fixes.
Les résultats de l'absorbity molaire sont:
2033, 2007, 2007, 1983, 2158, 1681, 2376, 1 872, 1862 en unités de 1 / (m * cm).
À partir de ces résultats, nous pouvons prendre la valeur moyenne:
= 1998 (m * cm) ^ - 1
Avec un écart-type de: 184 (m * cm) ^ - 1
L'erreur moyenne est l'écart type divisé par la racine carrée du numéro de données, c'est-à-dire:
Δ = 184/9 ^ 0,5 = 60 (m * cm) ^ - 1
Enfin, il est conclu que la substance brevetée a une absorption molaire à la fréquence 589 nm produite par une lampe de sodium de:
= (2000 ± 60) (m * cm) ^ - 1
Les références
- Atkins, P. 1999. Chimie physique. Éditions Omega. 460-462.
- Le guide. Transmittance et absorbance. Récupéré de: chimie.Laguia2000.com
- Toxicologie environnementale. Transmittance, absorbance et loi de Lambert. Récupéré de: le référentiel.Innovationumh.est
- Physique de l'aventure. Absorbance et transmittance. Récupéré de: rpfisica.Blogspot.com
- Sistophotométrie. Récupéré de: Chem.Bibliothèque.org
- Toxicologie environnementale. Transmittance, absorbance et loi de Lambert. Récupéré de: le référentiel.Innovationumh.est
- Wikipédia. Absorbance. Récupéré de: Wikipedia.com
- Wikipédia. Spectrophotométrie. Récupéré de: Wikipedia.com
- « Contexte de l'avant-garde d'Amérique latine, caractéristiques, auteurs
- Origines, caractéristiques, causes et conséquences du totalitarisme »

