Structure d'oxyde de chrome (III), nomenclature, propriétés, utilisations

- 4690
- 169
- Raphaël Meyer
Il Oxyde chromé (III) L'oxyde chromique U est un solide vert inorganique formé par le chrome métallique (CR) en oxygène (ou2), laisser Chrome avec l'état d'oxydation 3+. Sa formule chimique est CR2SOIT3. Dans la nature, il se trouve dans le minéral Eskolaíta. Les dépôts naturels de l'oxyde de chromé (III) ne sont pas connus.
Il peut être préparé entre autres manières en chauffant CR2SOIT3 hydraté (cr2SOIT3.NH2O) Pour éliminer complètement l'eau. Il est également obtenu comme produit de la calcination de l'oxyde de chrome (VI) (CRO3).
 Pigment d'oxyde chromé (III). FK1954 [domaine public]. Source: Wikipedia Commons
Pigment d'oxyde chromé (III). FK1954 [domaine public]. Source: Wikipedia Commons Cependant, la meilleure façon de l'obtenir pur est par décomposition du dichromate d'ammonium (NH4)2Croisement2SOIT7 à 200 ºC. Industriellement est produit par réduction du dichromate de sodium (NA2Croisement2SOIT7) solide avec du soufre.
Quand il est finement divisé, il présente une couleur vert vif avec des nuances jaunâtres. Mais si les particules sont plus grandes, elle présente un colorant bleuâtre. L'oxyde chromique est le pigment vert le plus stable qui soit connu. Sa résistance thermique et chimique en fait un précieux colorant en céramique.
Il est utilisé dans les revêtements industriels, les vernis, dans l'industrie de la construction, dans les bijoux, comme coloration dans les cosmétiques ou dans les produits pharmaceutiques, entre autres applications.
[TOC]
Structure
Oxyde α-CR2SOIT3 Il a la structure de type Corindon. Son système cristallin est hexagonal rhomboonique. Est isomorphe avec α-alumine et α-FE2SOIT3.
L'Eskolaíta, minéral naturel de l'oxyde de chromé (III), présente la structure ci-dessous:
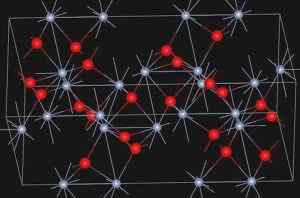 Structure cristalline du minéral d'Eskolaíta. https: // télécharger.Wikimedia.org / wikipedia / communes / e / ee / eskolaite_structure.Jpg. Source: Wikipedia Commons
Structure cristalline du minéral d'Eskolaíta. https: // télécharger.Wikimedia.org / wikipedia / communes / e / ee / eskolaite_structure.Jpg. Source: Wikipedia Commons Nomenclature
- Oxyde chromé (III).
- Oxyde de chrome vert.
- Trioxyde de dichrome.
- Chrome Sequooxyde.
- Chrome.
- Eskolaíta: minéral de l'oxyde de chrome (III).
- Hydrater: cr2SOIT3.NH2Ou (où n ≅ 2) est appelé hydrate d'oxyde chromé (iii) ou vert guignet.
 Hydrate d'oxyde de chromé (III). W. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikipedia Commons
Hydrate d'oxyde de chromé (III). W. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikipedia Commons Propriétés
État physique
Solide cristallin.
Dureté mohs
9 (leurs cristaux sont extrêmement difficiles).
Poids moléculaire
151,99 g / mol.
Peut vous servir: Composés quaternaires: caractéristiques, formation, exemplesPoint de fusion
Fond à 2435 ºC, mais il commence à s'évaporer à 2000 ºC formant des nuages de fumée verte.
Densité
5,22 g / cm3
Solubilité
Lorsqu'il a été chauffé à des températures élevées, il est pratiquement insoluble dans l'eau (3 microgrammes / L à 20 ° C); insoluble dans les alcools et l'acétone; légèrement soluble dans les acides et les alcalis; acide perchlorique ssoluble (HCLO4) à 70%, dans lequel il décompose.
pH
6.
Indice de réfraction
2 551.
Autres propriétés
- S'il est fortement calciné, il devient inerte envers les acides et les bases. Sinon le CR2SOIT3 et sa forme hydratée cr2SOIT3.NH2O Ils sont amphotériques, se dissolvant facilement dans l'acide pour donner des aqua-ions [cr (h2SOIT)6]]3+, et chez des alcalis concentrés pour former des "chromitos".
- Lorsqu'il a été calciné, il est chimiquement résistant aux acides, aux alcalis et aux températures élevées. Est extrêmement stable pour ainsi2.
- Il a une résistance exceptionnelle à la lumière car ses cristaux ont une opacité, une atténuation élevée des UV et une transparence à la lumière visible.
- C'est un matériau extrêmement dur, vous pouvez rayer le quartz, le tapacio et le zirconio.
- Son hydrate CR2SOIT3.NH2Ou (où n ≅ 2) n'a pas de stabilité thermique, son eau d'hydratation limite son applicabilité à moins de 260 ºC. Il présente une faible capacité de teinture et des nuances limitées des nuances.
- Mais cet hydrate a une teinte bleu vert très propre et vif. Il est semi-transparent, présente une faible opacité, une excellente résistance à la lumière et une résistance aux alcalis.
- Le CR2SOIT3 Il n'est pas classé comme un matériau dangereux et est considéré comme une poudre fine inerte. Il n'est pas soumis aux réglementations internationales des transports.
- N'irrite pas la peau ou les muqueuses.
Applications
Dans l'industrie de la céramique et du verre
En raison de sa forte résistance à la chaleur et à la résistance chimique, le Cr2SOIT3 Calciné est utilisé comme colorant ou pigment vitreux dans la fabrication en céramique, dans des émaux en porcelaine et des mélanges pour le verre.
Dans les revêtements industriels
La céramique avec de l'oxyde de chromé (III) offre une excellente résistance à la plupart des environnements corrosifs. Tout cela par le mécanisme d'exclusion du substrat environnant.
Pour cette raison, il est utilisé dans les revêtements pour empêcher la corrosion de nombreux matériaux, appliqués par pulvérisation thermique (atomisation ou rosée chaude).
Peut vous servir: Processus chimique: principes, types, exemplesIl est également utilisé comme protection contre l'usure abrasive (lorsque l'élimination du matériau est causée par des particules qui se déplacent à travers une surface).
Dans ces cas, l'application d'un revêtement CR2SOIT3 Par dépôt avec plasma, il génère une forte résistance à l'abrasion.
Les deux cas précédents ont une utilité, par exemple, dans des moteurs à turbine turospaciale à gaz.
Dans l'industrie réfractaire
Il est utilisé dans les briques thermiquement et chimiquement résistantes, les matériaux de revêtement et le béton réfractaire à base d'alumine.
En construction
Puisqu'il est extrêmement résistant aux conditions atmosphériques, à la lumière et à la chaleur, il est appliqué comme un colorant rocheux granulé pour les toits d'asphalte, le ciment en béton, les revêtements industriels de haute qualité pour les constructions en acier et les façades en acier (peintures émulsiables).
Comme pigment dans des applications variées
Il peut prendre en charge les conditions de vulcanisation et ne se dégrade pas, il est donc utilisé dans la pigmentation en caoutchouc.
Parce qu'ils sont non techniques, il est utilisé comme pigment pour les jouets, les cosmétiques (en particulier son hydrate), les plastiques, les encres d'impression, les peintures qui entrent en contact avec les produits alimentaires et les produits pharmaceutiques.
Dans l'industrie des pigments, il est utilisé comme matière première pour produire des colorants pénétrants qui contiennent du chrome et des pigments basés sur des phases d'oxydes métalliques mélangés. Il est également utilisé comme coloration des peintures pour le revêtement de bobine.
Son hydrate a une transparence qui permet la formulation de finitions polychromatiques dans l'industrie automobile (finitions de voitures métalliques).
En raison de sa caractéristique unique de refléter le rayonnement infrarouge (IR) similaire à la chlorophylle des plantes, sous la lumière infrarouge, il semble le feuillage. Pour cette raison, son utilisation dans les peintures ou les revêtements de camouflage pour les applications militaires est très répandu.
En bijoux
Il est utilisé comme colorant de joyaux synthétiques. Lorsque CR est introduit2SOIT3 comme impureté dans le réseau cristallin de α-al2SOIT3, Comme dans le minéral rubis semi-précieux, la couleur est rouge au lieu du vert.
Il est également utilisé comme agent de broyage et poli pour la dureté élevée et les propriétés abrasives.
Sur les réactions chimiques
Soutenu en alumine (à2SOIT3) ou d'autres oxydes, est utilisé dans la chimie organique comme catalyseur, par exemple, dans l'hydrogénation des esters ou des aldéhydes pour former des alcools et dans la cyclisation des hydrocarbures. Catalyse la réaction de l'azote (n2) avec de l'hydrogène (H2) Pour former de l'ammoniac (NH3).
Il peut vous servir: lithium: histoire, structure, propriétés, risques et utilisationsPour sa capacité de réduction d'oxyde agissant avec l'oxyde de chrome (VI) joue un rôle important dans la déshydrogénation des alcanes2 Pour produire du propeno et de l'isobutène, car le cycle de réactivation de la désactivation du catalyseur est facilement exécutable. Il est également utilisé comme catalyseur en chimie inorganique.
Dans la fabrication chromée
Il est utilisé dans la production en aluminothermie chromée pure. Pour ce faire, il doit être chauffé à 1000 ºC afin d'augmenter sa taille de grain.
 Préparation des métaux chromés par réduction en aluminothermique de l'oxyde de chrome (III). Rando Tuikene [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikipedia Commons
Préparation des métaux chromés par réduction en aluminothermique de l'oxyde de chrome (III). Rando Tuikene [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikipedia Commons Dans les matériaux magnétiques
Il a été ajouté en petites quantités aux matériaux magnétiques des bandes audio et vidéo en enseignant un effet auto-impressionnant aux têtes sonores.
Innovations récentes
Il a été obtenu des pigments qui ont amélioré la réflectance de près des nanoparticules Dopar CR2SOIT3 avec des sels d'éléments appartenant au groupe de terres rares, comme le Lantano et le Praseodimio.
En augmentant la concentration de ces éléments, la réflectance solaire de l'infrarouge proche augmente sans affecter la couleur verte du CR Pig2SOIT3.
Cela permet de classer CR2SOIT3 dopant comme un pigment "froid", car il convient pour contrôler l'accumulation de chaleur.
Appliqué aux plafonds, aux voitures et à l'ameublement, entre autres applications, atteint une réflectance élevée de la lumière du soleil IR, ce qui nous permet de réduire considérablement l'augmentation de la chaleur dans les environnements.
Les références
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- Kirk-othmer (1994). Encyclopédie de la technologie chimique. Volume 19. Quatrième édition. John Wiley & Sons.
- Encyclopédie de la chimie industrielle d'Ullmann. (1990). CINQUIÈME ÉDITION. Volume A7 et A20. VCH VERLAGSGELLSCHAFT MBH.
- Éléments américains. (2019). Chrome (iii) oxyde. Récupéré des Américains.com.
- Bibliothèque nationale de médecine. (2019). Chrome (iii) oxyde. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement.
- Dorfman, Mitchell R. (2012). Revêtements de pulvérisation thermique. Dans le manuel de dégradation de l'environnement des matériaux. Chapitre 19. Récupéré de ScienceDirect.com.
- Takehira, k. et al. (2004). CO2 Déshydrogénation du propane sur le catalyseur CR-MCM-41. Dans des études en science de surface et catalyse 153. Récupéré de ScienceDirect.com.
- Selvam Sangeetha et al. (2012). Pigments fonctionnels de l'oxyde de nanoparticules de chrome (III). Colorants et pigments 94 (2012) 548-552. Récupéré de ScienceDirect.com.

