Structure de Torio, propriétés, obtention, utilisations

- 4720
- 742
- Paul Dumas
Il Torio C'est un élément métallique qui appartient à la série d'actinides, des terres rares si appelées, et dont le symbole chimique est th. Il a un nombre atomique de 90 et un poids atomique de 232 g / mol. Les composés Torio le contiennent généralement avec le numéro d'oxydation +4 (Th4+).
Le composé de dioxyde de torio, tho2, Il est connu industriellement sous le nom de Toria, et est utilisé dans la plupart des applications du Torium, caractérisé par le composé chimique avec le plus grand point de fusion (3 (3.300 ºC).
 Échantillon de thorium métallique stocké dans une ampoule en verre sous argon. Son revêtement noirâtre est dû à son oxyde. Source: Alchemist-HP (Talk) (www.Pse-mendelejew.de) / fal
Échantillon de thorium métallique stocké dans une ampoule en verre sous argon. Son revêtement noirâtre est dû à son oxyde. Source: Alchemist-HP (Talk) (www.Pse-mendelejew.de) / fal Le Torio a été découvert en 1828 par le mortier Thrane Esmark, qui a trouvé sur l'île norvégienne de Løvøya un minéral noir. Esmark a livré le minéral à Jöns Jacob Berzelius, qui l'a analysé pour trouver un métal inconnu en lui.
Il a appelé le minéral noir comme Torita (Thorita) en l'honneur du dieu scandinave Thor. Pendant ce temps, le métal inconnu s'appelait Torio (thorium). Le caractère radioactif du thorium a été créé par Anton Edward Van Arkel et Jan Hendrik de Boer, et indépendamment par Pierre Curie et Marie Curie.
[TOC]
Propriétés du torium
Physique
Le thorium est un métal blanc radioactif, brillant, modérément dur, argenté, ductile et malléable, qui brouillonne très lentement dans l'air, devenant gris et plus tard noir. Il appartient au groupe d'actinides, s'identifiant au numéro atomique 90 et à un poids atomique de 232 g / mol.
Radioactivité
Le Torio-232 (232E90) constitue plus de 99% de l'élément de thorium total présent dans le cortex terrestre. On peut considérer qu'il s'agit d'un isotope stable, bien qu'il soit radioactif, car sa demi-vie est 1.405 x 10dix années. Diminue radioactive par émission de particules α et β et le rayonnement γ.
Le Torio-232 est transformé en radio-268 (268Rampe88) en émettant une particule alpha, constituée de deux protons et deux neutrons. Le thorium peut subir une série de désintégrations radioactives jusqu'à ce qu'elle devienne un élément stable: lead-208.
Peut vous servir: chlorure de plomb: propriétés, structure, utilisationsLe Torio-232 est capable d'attraper des neutrons pour se transformer en élément radioactif de l'uranium-233, émettant un rayonnement de type β. L'uranium, en revanche, est utilisé dans les réacteurs nucléaires pour la production d'énergie.
Réactivité
Le thorium est un métal électropositif et hautement réactif. Il s'oxyde très lentement dans l'air, bien que la corrosion puisse se produire après plusieurs mois. Lorsqu'il est chauffé dans l'air, il est allumé, émettant une lumière blanche brillante pendant la production de dioxyde de torio, tho2.
Dans des conditions de température et de pression standard, le thorium est lentement attaqué par l'eau. De même, le thorium n'est pas dissous dans les acides les plus courants, à l'exception de l'acide chlorhydrique, où il se dissout en laissant un résidu noir et insoluble.
Il est également dissous dans l'acide nitrique concentré avec une petite quantité de fluorate catalytique ou fluorosyle. Le thorium est un métal pyrophorique: lorsqu'il devient en poudre, il est capable de s'enflammer spontanément.
Structure
Les atomes de Torio forment une structure cubique en cristal centré sur les faces (FCC) à température ambiante. Lorsqu'il est chauffé au-dessus de 1360 ºC, le verre souffre d'une transition vers la phase cubique centrée sur le corps (BCC), de densité inférieure. Pendant ce temps, le thorium sous haute pression (100 GPa ou plus), acquiert une structure tétragonale dense centrée sur le corps (BCT).
Configuration électronique
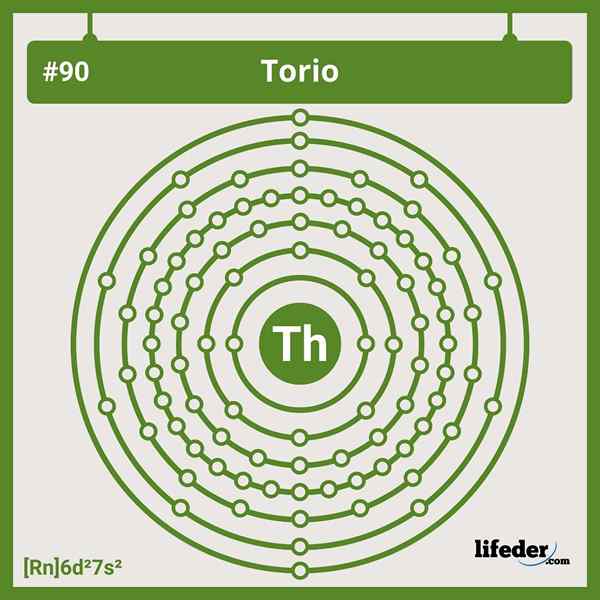 Paramètres électroniques du torium
Paramètres électroniques du torium La configuration électronique abrégée du thorium est la suivante:
[RN] 6d2 7s2
Perdre ses quatre électrons Valencia se transforme en thr cation4+. Notez qu'en dépit d'être un jeu, il manque d'électrons dans ses orbitales 5F, contrairement aux autres actinides.
Peut vous servir: phase de dispersionObtention
Le minéral principal utilisé pour obtenir le thorium est la monacite. L'étape initiale est sa séparation de son dépôt principal: le pegmatita. Les métaux alcalinotherres carbonates sont éliminés de la pegmatite par réaction de leurs fragments avec du chlorure d'hydrogène.
Les fragments résultants sont calcinés et filtrés, puis subissant une séparation magnétique. Ainsi un matériau sableux de Monacita est obtenu. Ce sable est soumis à une digestion à 93% d'acide sulfurique, à une température de 210 à 230 ° C, et pendant plusieurs heures. La solution acide formée est plus tard diluée avec de l'eau dix fois son volume.
Les restes de Monacita coulent au fond, tandis que le thorium et les autres éléments de la terre rare flottent en préparation acide. Le pH à 1 est ajusté.3, qui produit la précipitation du thorium comme phosphate, tandis que le reste des rares terres en suspension reste en solution.
Actuellement, la séparation et la purification sont réalisées à l'aide de solvants liquides, par exemple, hommage phosphate dans Queroseno.
Torio Metal peut se produire en quantités commerciales par réduction des métalothermales de Totrafluoruro de Torio (THF4) et le dioxyde de torio (tho2), ou par électrolyse du tétrachlorure de thorium (THCL4).
Applications
Le thorium a eu de nombreuses applications, dont beaucoup ont été jetées depuis les années 1950, car son caractère radioactif constituait un risque pour la santé.
Industriels
Alliages
Le thorium a été allié avec le tungstène comme électrode dans le soudage TIG (gaz inerte tungstène), constituant 2% de l'alliage.
En petites quantités, Torio a été ajouté aux filaments de tungstène pour réduire sa cristallisation, permettant ainsi à l'émission d'électrons à des températures plus basses. Des fils de tungstène-torio ont été utilisés dans les tubes électroniques et dans les électrodes des tubes de rayons X et de redresseurs.
Le dioxyde de torio a été utilisé dans le soudage à l'arc de tungstène, car la résistance au tungstène à des températures élevées d'électrodes métalliques augmente. Cependant, il a été remplacé dans cette application par les oxydes Cinking, Cerio ou Lantano.
Peut vous servir: d'où vient le plastique? Historique et typesFoudre
Totrafluoruro de Torio, en revanche, a été utilisé comme matériau pour réduire les réflexes dans les revêtements optiques multicapa, qui sont transparents à la lumière avec une longueur d'onde entre 0.350 à 1.2 µm. Cependant, le torio sel a été remplacé dans cette utilisation par le Tetrafluoro de Lantano.
Le dioxyde de torio a été utilisé dans l'éclairage de la lumière, pour émettre une lumière brillante correspondant à la lumière visible. Bien que le thorium soit toujours utilisé dans cette application, il a été partiellement remplacé par l'ITE.
Matériaux réfractaires
Le thorium a également été utilisé dans l'élaboration de matériaux réfractaires pour l'industrie métallurgique et dans les crisols en céramique pour les laboratoires d'enseignement et de recherche.
Réacteurs nucléaires
Le Torio-232 est utilisé dans les réacteurs nucléaires pour capter les neutrons de mouvement, car cela est transformé en uranium-233. Cet élément radioactif est physiquement et est utilisé pour la production d'énergie.
Le développement de réacteurs nucléaires basés sur le Torio-32 a été lent, créant le premier réacteur avec cette caractéristique du Indian Point Energy Center, situé à Buchanan USA, en 1962. Les réacteurs nucléaires du Torio-232 n'émettent pas le plutonium, ce qui en fait moins de polluants.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (quatrième édition). Mc Graw Hill.
- Wikipédia. (2020). Thorium. Récupéré de: dans.Wikipédia.org
- Centre national d'information sur la biotechnologie (2020). Thorium. PubChem Comunund Résumé pour CID 23974. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Docteur. Doug Stewart. (2020). Faits d'élément thorium. Récupéré de: Chemicool.com
- Les éditeurs d'Enyclopaedia Britannica. (2020). Thorium. Récupéré de: Britannica.com
- Lentech b.V. (2020). Thorium. Récupéré de: lentech.com
- Rachel Ross. (1er mars 2017). Faits sur le thorium. Récupéré de: LiveScience.com
- Advameg. (2020). Thorium. Récupéré de: chimie-explayée.com

