Fournir diverses caractéristiques, structure, fonctions
- 715
- 177
- Raphaël Meyer
Le Superoxyde de dysmutas (Gazon) soit superoxyde oxydé, Ils constituent une famille d'enzymes omniprésents dans la nature, dont la fonction principale consiste en la défense des organismes aérobies contre les radicaux sans oxygène, en particulier les radicaux anioniques superoxyde.
La réaction que ces enzymes catalysent se produit pratiquement dans toutes les cellules capables de respirer (aérobic) et sont essentielles à leur survie, car elle élimine une toxique radical sans oxygène, à la fois chez les eucaryotes et les procaryotes.
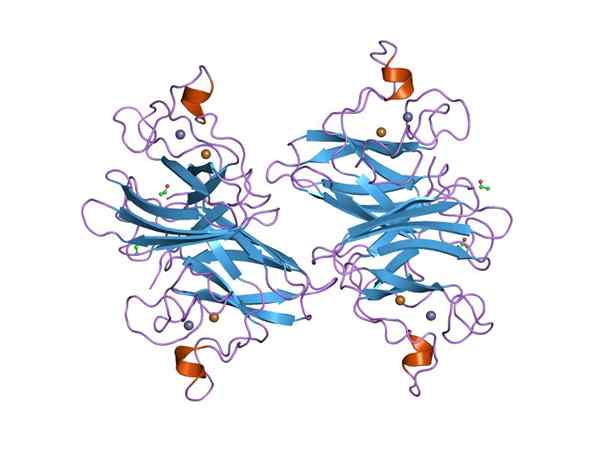
 Représentation graphique d'un superoxyde de dymputase (SOD) Cu-Zn (Source: Jawahar Swaminathan et MSD Staff de l'Institut européen de bioinformatique [Domaine public] via Wikimedia Commons) via Wikimedia Commons)
Représentation graphique d'un superoxyde de dymputase (SOD) Cu-Zn (Source: Jawahar Swaminathan et MSD Staff de l'Institut européen de bioinformatique [Domaine public] via Wikimedia Commons) via Wikimedia Commons) De nombreuses maladies chez les animaux sont liées à l'accumulation de différentes espèces réactives de l'oxygène, et il en va de même pour les plantes, étant donné que l'environnement impose de nombreux et constants types de stress oxydatif qui sont surmontés grâce à l'activité de abandon le superoxyde.
Ce groupe d'enzymes a été découvert en 1969 par McCord et Fridovich et depuis lors, des progrès considérables ont été réalisés concernant ces enzymes et les réactions qui catalysent les êtres vivants.
[TOC]
Caractéristiques
Les dysmutas superoxyde réagissent avec les radicaux superxydes à des taux vraiment élevés, ce qui se traduit par une ligne de défense très efficace pour l'élimination de ces molécules.
Chez les mammifères, au moins trois isoformes ont été décrites pour la dysmutase de surroxyde connue sous le nom de SOD1, SOD2 et SOD3, respectivement.
Deux de ces isoformes ont des atomes de cuivre et de zinc dans leurs centres catalytiques et diffèrent les uns des autres en termes de localisation: intracellulaire (cytosolique, SOD1 ou Cu / Zn-SOD) ou avec des éléments extracellulaires (EC-SOD ou SOD3).
L'isoforme SOD2 ou MN-SOD, contrairement aux deux précédentes, a un atome de manganèse en tant que cofacteur et son emplacement semble limité aux mitochondries des cellules aérobies.
Les isoenzymes SOD1 sont principalement dans le cytosol, bien qu'ils aient également été détectés dans le compartiment nucléaire et les lysosomes. Les isoenzymes SOD 3, au contraire, ont été décrits dans le plasma sanguin des humains, dans les fluides lymphatiques et cérébraux.
Peut vous servir: comment les êtres vivants changent-ils avec le temps?Chacune de ces isoformes est codée par différents gènes, mais appartenant à la même famille et à sa régulation transcriptionnelle est essentiellement contrôlée par des conditions extra-intracellulaires, qui déclenchent différentes cascades de signalisation internes.
Autre superoxyde de liminité
Le superoxyde dysmonique avec des sites catalytiques qui ont du cuivre et du zinc ou des ions manganèse ne sont pas uniques aux mammifères, ceux-ci sont également présents dans d'autres organismes qui incluent des plantes et des bactéries de différentes classes.
Il y a un groupe supplémentaire de superroxyde de dysmutas, qui ne se trouve pas chez les mammifères, et qui sont facilement reconnaissables, car à leur place active, ils ont du fer au lieu de l'un des trois ions précédemment décrits pour les autres classes de superoxyde dysmateux.
Dans ET. coli, La dysmique de surroxyde -In qu'il contient du fer est une enzyme perplastique également en charge de la détection et de l'élimination des radicaux sans oxygène générés pendant la respiration. Cette enzyme est similaire à celle trouvée dans les mitochondries de nombreux eucaryotes.
Les plantes ont les trois types d'enzymes: celles qui contiennent du cuivre et du zinc (Cu / Zn-SOD), qui contiennent du manganèse (MN-SOD) et de celles contenant du fer (Fe-SOD) dans leur centre actif et dans ces organismes, ils font de l'exercice fonctions analogues à celles des enzymes non végétales.
Réaction
Les substrats enzymatiques de dysmées-superoxyde sont des anions superoxyde, qui sont représentés comme O2- et qui sont des composés intermédiaires dans le processus de réduction de l'oxygène.
La réaction qu'ils catalysent peut être envisagée dans des lignes générales telles que la transformation (disputation) des radicaux libres pour la formation d'oxygène moléculaire et de peroxyde d'hydrogène, qui sont libérés dans l'environnement ou les employés en tant que substrat d'autres enzymes, respectivement.
Peut vous servir: Glucans: structure, caractéristiques et fonctionsLe peroxyde d'hydrogène peut être éliminé par la suite des cellules grâce à l'action de l'une des enzymes de glutathion mais de la peroxydase et de la catalase, qui exercent également des fonctions importantes dans la protection cellulaire.
Structure
Les isoenzymes de superoxyde de dysmutas chez l'homme peuvent différer les uns des autres en termes de certains aspects structurels. Par exemple, l'isoenzyme SOD1 a un poids moléculaire de 32 kDa, tandis que SOD2 et SOD3 sont des homotétrices de 95 et 135 kDa.
L'autre groupe de superoxyde dysmateux, le Fe-Sod présent dans les plantes et autres organismes autres que les mammifères, sont des enzymes dimérrica de sous-unités identiques, c'est-à-dire que ce sont des homodimères.
Dans certaines plantes, ces Fe-SOD contiennent une séquence de signal N-terminale putative pour le transport à l'intérieur des chloroplastes et d'autres contiennent une séquence C-terminale de transport de tractive vers les peroxysomes, il est donc présumé que sa distribution subcellulaire est restreint les deux compartiments.
La structure moléculaire des trois types d'enzymes de surexcident est consultée, en substance, par les hélices alpha et les feuilles de type B.
Les fonctions
Le superoxyde dysmique défend les cellules, les organes et les tissus corporels de dommages que les radicaux sans oxygène peuvent provoquer comment la peroxydation lipidique, la dénaturation des protéines et la mutagenèse de l'ADN.
Chez les animaux, ces espèces réactives peuvent également provoquer des lésions cardiaques, accélérer le vieillissement et participer au développement de maladies inflammatoires.
Les plantes ont également besoin de l'activité enzymatique essentielle de la dysmutase tropoxyde, car de nombreuses conditions stressantes de l'environnement augmentent le stress oxydatif, c'est-à-dire la concentration d'espèces réactives délétères.
Chez l'homme et d'autres mammifères, les trois isoformes décrites pour la dysmutase de surroxyde ont des fonctions différentes. L'isoenzyme SOD2, par exemple, participe à la différenciation cellulaire et à la tumorogenèse et également à la protection contre la toxicité pulmonaire induite par l'hyperoxie (concentration élevée en oxygène).
Peut vous servir: inuline: structure, propriétés, nourriture, contre-indicationsPour certaines espèces de bactéries pathogènes, les enzymes à gaz.
Maladies connexes
Une diminution de l'activité de la dysmutase superoxyde peut être donnée par plusieurs facteurs, à la fois internes et externes. Certains sont liés à des défauts génétiques directs dans les gènes codants pour les enzymes SOD, tandis que d'autres peuvent être indirects, liés à l'expression de molécules régulateurs.
Un grand nombre de conditions pathologiques des êtres humains sont liées aux enzymes SOD, notamment l'obésité, le diabète, le cancer et d'autres.
En ce qui concerne le cancer, il a été déterminé qu'il existe un grand nombre de types de tumeurs cancéreuses qui ont de faibles niveaux de l'un des trois superoxyde de mammifères (SOD1, SOD2 et SOD3).
Le stress oxydatif que l'activité de superoxyde dismutase prévient est également associé à d'autres pathologies articulaires telles que l'arthrose, la polyarthrite rhumatoïde. Beaucoup de ces maladies ont à voir avec l'expression de facteurs qui inhibent l'activité SOD, comme le facteur TNF-α.
Les références
- Fridovich, je. (1973). Swiden Dysmuta. Anneau. Tour. Biochimie., 44, 147-159.
- Johnson, F., & Giulivi, c. (2005). Les dysmutes superoxyde et l'impact de la messagerie instantanée sur la santé humaine. Aspects de la médecine moléculaire, 26, 340-352.
- Oberley, L. W., & Bueftner, g. R. (1979). Rôle du superoxyde Distine dans le cancer: une revue. Recherche contre le cancer, 39, 1141-1149.
- Taylor, P., Bowler, C., Camp, w. Van, Montagu, M. Van, Inzé, D., & Rôti, k. (2012). Superoxyde dénigré dans les plantes. Revues critiques dans les sciences des plantes, 13(3), 37-41.
- Zelko, je., Mariani, t., & Folz, r. (2002). SUPEROXIDE DISTAM Multigene Famille: En comparaison des structures de gènes, de l'évolution et de l'expression Cuzn-SOD (SOD1), MN-SOD (SOD2) et EC-SOD (SOD3). Biologie et médecine des radicaux libres, 33(3), 337-349.
- « Caractéristiques des oligosaccharides, composition, fonctions, types
- Biographie José Rubén Romero, style, œuvres »

