Structure de sulfure de cuivre, propriétés, utilisations

- 2690
- 115
- Raphaël Meyer
Il sulfure de cuivre C'est une famille de composés inorganiques dont la formule chimique générale est CUXSet. Ouais X C'est plus grand que et Cela signifie que ce sulfure est plus riche en cuivre qu'en soufre; Et si au contraire, X C'est plus petit que et, Puis le sulfure est plus riche en soufre que dans le cuivre.
De nature, de nombreux minéraux qui représentent les sources naturelles de ce composé prédominent. Presque tous sont plus riches en cuivre qu'en soufre, et leur composition est exprimée et simplifiée par la formule avecXS; ici X Vous pouvez même prendre des valeurs fractionnaires, indiquant un solide stœchiométrique (Cu1.75S, par exemple).
 Un échantillon de Covellita Mineral, l'une des nombreuses sources naturelles de sulfure de cuivre. Source: James St. John [CC par 2.0 (https: // CreativeCommons.Org / licences / par / 2.0)]
Un échantillon de Covellita Mineral, l'une des nombreuses sources naturelles de sulfure de cuivre. Source: James St. John [CC par 2.0 (https: // CreativeCommons.Org / licences / par / 2.0)] Bien qu'à l'état élémentaire, le soufre soit jaune, ses composés dérivés ont l'air de couleurs sombres; Tels se produit également avec du sulfure de cuivre. Cependant, le minéral Covelita (image supérieure), qui est principalement composé de CU, présente des paillettes métalliques et une irisation bleuâtre.
Ils peuvent être préparés à partir de différentes sources de cuivre et de soufre, en utilisant différentes techniques et variant les paramètres de synthèse. Ainsi, vous pouvez obtenir des nanoparticules CUS avec des morphologies intéressantes.
[TOC]
Structure de sulfure de cuivre
Liens
Ce composé a l'apparence d'être cristallin, vous pouvez donc immédiatement penser qu'il est composé d'ions Cu+ (Cuivre monovalent), Cu2+ (Cuivre divalent), s2- E, même, s2- et s22- (disulfur anions), qui interagissent à travers les forces électrostatiques ou la liaison ionique.
Cependant, il existe un léger caractère covalent entre Cu et S, et par conséquent, le lien Cu-S ne peut pas être exclu. À partir de ce raisonnement, la structure cristalline du CUS (et celle de tous ses solides dérivés) commence à différer de celles trouvées ou caractérisées pour d'autres composés ioniques ou covalents.
En d'autres termes, on ne peut pas parler d'ions purs, mais qu'au milieu de ses attractions (cation-anion), il y a un léger chevauchement de ses orbitales externes (partage d'électrons).
Coordinations dans la Covelita
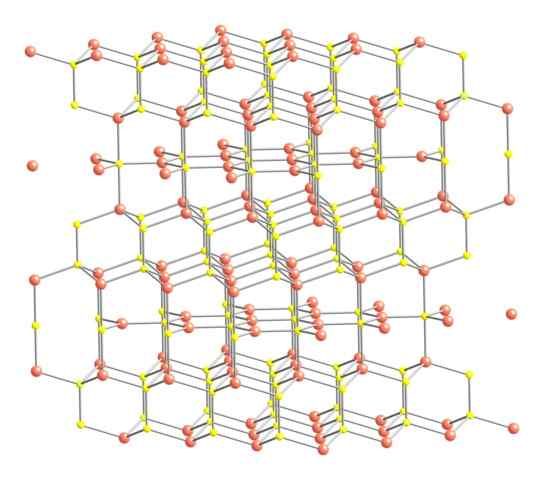 Structure cristalline de la Covellita. Source: Benjah-Bmm27 [domaine public].
Structure cristalline de la Covellita. Source: Benjah-Bmm27 [domaine public]. Après avoir dit ce qui précède, la structure cristalline de la covelite est montrée dans l'image. Il se compose de cristaux hexagonaux (définis par les paramètres de leurs cellules unitaires), où les ions se lient et guident dans différentes coordinations; Ce sont, avec un nombre varié de voisins à proximité.
Peut vous servir: type de lien de 02Dans l'image, les ions en cuivre sont représentés avec des sphères roses, tandis que le soufre aux sphères jaunes.
En concentrant l'attention d'abord sur les sphères roses, il sera noté que certains sont entourés de trois sphères jaunes (coordination plate trigonale) et d'autres pour quatre (coordination tétraédrique).
Le premier type de cuivre, le trigonal, peut être identifié dans les plans perpendiculaires aux faces hexagonales qu'ils donnent envers le lecteur, dans lesquelles ils sont à leur tour le deuxième type de carbone, tétraédrique.
Assisant maintenant aux sphères jaunes, certains ont cinq sphères roses (coordination bipyramide trigonale) et trois autres et une sphère jaune (encore une fois, coordination tétraédrique); Dans ce dernier, c'est devant l'anion disulfure, qui peut être visualisé vers le bas et dans la même structure de la covelite:
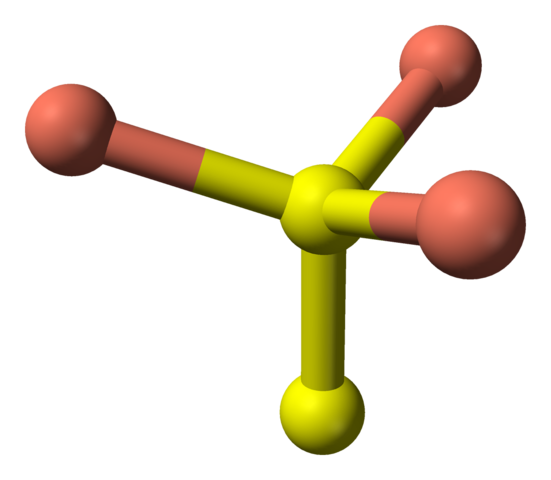 Coordination tétraédrique de l'anion disulfure dans la Covellita. Source: Benjah-Bmm27 [domaine public].
Coordination tétraédrique de l'anion disulfure dans la Covellita. Source: Benjah-Bmm27 [domaine public]. Formule alternative
Il y a alors des ions Cu2+, Cu+, S2- et s22-. Cependant, des études menées avec la spectroscopie photoélectronique XPS (XPS), ils soulignent que tout le cuivre est comme les cations CU+; Et par conséquent, la formule CUS initiale est exprimée "mieux" comme (Cu+)3(S2−) (S2)-.
Notez que la relation Cu: S pour la formule précédente continue d'être 1, et que les charges sont annulées.
Autres cristaux
Un sulfure de cuivre peut adopter des cristaux ortorrombiques, comme dans le polymorphe, γ-Cu2S, de la calcocita; cubique, comme dans un autre polymorphe de calcite, α-Cu2S; Tétragonal, dans le minéral anilita, Cu1.75S; monoclinique, dans le djurleita, cu1.96S, entre autres.
Pour chaque verre défini, il y a un minéral, et à son tour, chaque minéral a ses propres caractéristiques et propriétés.
Propriétés
Général
Les propriétés du sulfure de cuivre sont soumises à la relation Cu: S de leurs solides. Par exemple, ceux qui présentent des anions22- Ils ont des structures hexagonales et peuvent être des semi-conducteurs ou des conducteurs métalliques.
Peut vous servir: phosphate de potassium (K3PO4): structure, propriétés, utilisationsSi d'un autre côté, le contenu en soufre se compose d'anions2-, Les sulfures se comportent comme des semi-conducteurs, et présentent également des conductivités ioniques à des températures élevées. En effet.
Optiquement, bien qu'il dépend également de sa composition en cuivre et en soufre, les sulfures peuvent ou non absorber le rayonnement dans la région infrarouge du spectre électromagnétique. Ces propriétés optiques et électriques font de la mise en œuvre des matériaux potentiels dans différents appareils.
Une autre variable à considérer, en plus de la relation CU: s, est la taille des cristaux. Non seulement il s'agit de sulfures de cuivre "soufre" ou "cuivrés", mais les dimensions de leurs cristaux confèrent un effet inexact sur leurs propriétés; Ainsi, les scientifiques sont impatients d'étudier et de rechercher des applications aux nanoparticules CUXSet.
Flore
Chaque minéral ou sulfure de cuivre a des propriétés uniques. Cependant, de tous, la Covelita est la plus intéressante d'un point de vue structurel et esthétique (en raison de son irisation et de ses tons bleus). Par conséquent, certaines de ses propriétés sont mentionnées ci-dessous.
Masse molaire
95 611 g / mol.
Densité
4,76 g / ml.
Point de fusion
500 ° C; Mais ça tombe en panne.
Solubilité dans l'eau
3,3 · 10-5 G / 100 ml à 18 ° C.
Applications
Nanoparticules en médecine
Ne va pas seulement la taille des particules jusqu'à atteindre. Ainsi, le sulfure de cuivre peut former des nanosphères, des tiges, des plaques, des films minces, des cages, des câbles ou des tubes.
Ces particules et leurs morphologies attrayantes acquièrent des applications individuelles dans différents terres de médecine.
Par exemple, les nanojaulas ou les sphères vides peuvent servir de transporteurs de médicaments dans le corps. Des nanosferas ont été utilisés, soutenus par du verre de carbone et des nanotubes de carbone, pour servir de détecteurs de glucose; ainsi que leurs agrégats sont sensibles aux détections de biomolécules telles que l'ADN.
Il peut vous servir: 6 indicateurs de pH naturels et leurs caractéristiquesLes nanotubes CUS dépassent les nanosferas dans la détection du glucose. En plus de ces biomolécules, les immunocapteurs ont été conçus à partir de couches minces de CU et de certains supports pour la détection pathogène.
Les nanocristaux et les agrégats amorphes de CU peuvent même provoquer une apoptose des cellules cancéreuses, sans endommager les cellules saines.
Nanoscience
Dans la sous-section antérieure, il a été dit que leurs nanoparticules faisaient partie des biocapteurs et des électrodes. En plus de ces utilisations, les scientifiques et les techniciens ont également profité de leurs propriétés pour concevoir des cellules solaires, des condensateurs, des batteries au lithium et des catalyseurs pour des réactions organiques très spécifiques; Éléments indispensables dans les nanosciences.
Il convient également de mentionner que lorsqu'ils sont pris en charge sur du carbone activé, l'ensemble NPCUS-CA (CA: Carbon activé et NP: nanoparticules) a été prouvé de dissolvant des colorants nocifs pour l'homme et, par conséquent, des fonctions de purificateur de purificateur Sources de sources de molécules indésirables absorbant l'eau.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Sulfure de cuivre. Récupéré de: dans.Wikipédia.org
- Ivan Grozdanov et Methodija Najdoski. (Année mille neuf cents quatre-vingts-quinze). Propriétés optiques et électriques des films de sulfure de cuivre de composition variable. Journal of Solid State Chemistry Volume 114, numéro 2, 1 février 1995, pages 469-475. est ce que je.org / 10.1006 / JSSC.Année mille neuf cents quatre-vingts-quinze.1070
- Centre national d'information sur la biotechnologie. (2019). Sulfure de cuivre (CUS). Base de données PubChem. CID = 14831. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Peter A. Ajibade et nandipha l. Botha. (2017). Synthèse, propriétés optiques et structurelles
- de nanocristaux de sulfure de cuivre à partir de précurseurs à molécule unique. Département de chimie, Université de Fort Hare, sac privé X1314, Alice 5700, Afrique du Sud. Nanomatériaux, 7, 32.
- Collaboration: auteurs et éditeurs des volumes III / 17E-17F-41C (S.F.). Sulfures de cuivre (Cu2S, Cu (2-X) S Structure cristalline, paramètres latices. Dans: Madelung ou., Rössler u., Schulz m. (eds) Éléments non liés à la tétrame et composés binaires I. Landolt-Börnstein-Groupe III Matter condensé (données numériques et relations fonctionnelles en science et technologie), vol 41c. Springer, Berlin, Heidelberg.
- Momtan, f., Vafaei, un., Ghaedi, m. et al. J. coréen. Chem. Engin. (2018). Application de nanoparticules de sulfure de cuivre chargé de carbone activé pour une adsorption simultanée des colorants terminaux: méthodologie de surface de réponse. 35: 1108. est ce que je.org / 10.1007 / s11814-018-0012-1
- Goel, s., Chen, F., & Cai, W. (2014). Synthèse et applications biomédicales des nanoparticules de sulfure de cuivre: des capteurs aux théranostiques. Small (Weinheim an der Bergstrasse, Allemagne), 10 (4), 631-645. Doi: 10.1002 / smll.201301174

