Structure du pentahydrate de sulfate de cuivre, propriétés, utilisations

- 3814
- 409
- Eva Henry
Il Pentahydrate de cuivre sulfate Il s'agit d'un composé inorganique formé par le cuivre (Cu), le (s), l'oxygène (O) et l'eau (H2SOIT). Contient des ions cuivre (ii) (Cu2+) et sulfate (donc42-). Sa formule chimique est cuso4 •5h2SOIT.
Dans la nature, il forme le chalcantita ou le minéral calcant, également appelé chalclasa ou calclasa. C'est un solide cristallin bleu.
 Sulfate de cuivre sulfate de cuivre cuso4 •5h2SOIT. Auteur: überraschungsbilder. Source: Wikimedia Commons.
Sulfate de cuivre sulfate de cuivre cuso4 •5h2SOIT. Auteur: überraschungsbilder. Source: Wikimedia Commons. Il est utilisé comme complément nutritionnel à certains animaux tels que les ruminants, les porcs et la volaille. Dans l'agriculture, il sert de pesticide. Dans les activités minières, il permet de récupérer d'autres métaux.
Car sa teinte bleue sert à la coloration des tissus et des métaux. Il a été utilisé pour déposer du cuivre métallique sur les fibres de cellulose pour obtenir des tissus conducteurs électriques. Il est également utilisé pour préparer des nanoparticules de cuivre et ses oxydes, avec une variété d'applications.
En concentrations élevées, il peut être toxique pour la faune et la flore, donc parfois il est utilisé pour éliminer les ravageurs (animaux ou plantes) des environnements aquatiques tels que les lagunes et les étangs naturels.
[TOC]
Structure
Ce composé est formé par l'élément de cuivre dans son état d'oxydation +2 et l'anion sulfate. Ce dernier a un atome de soufre avec Valencia +6 entouré de quatre atomes d'oxygène, chacun avec Valencia -2. De cette façon, l'ion sulfate a deux charges négatives.
Il a également 5 molécules d'eau dans sa structure. Dans la figure suivante, vous pouvez voir la façon dont les différents atomes du verre sont disposés.
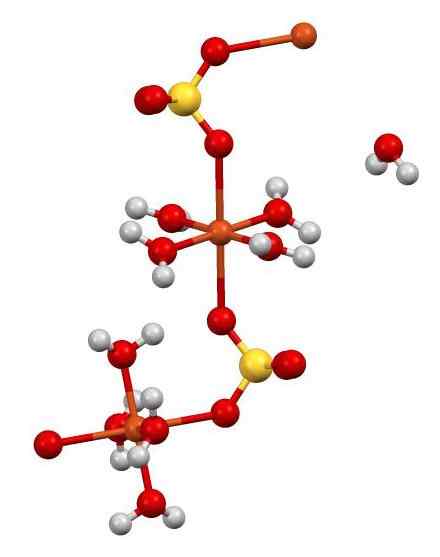 Structure Cuo4 •5h2SOIT. Auteur: Smokefoot. Source: Wikimedia Commons.
Structure Cuo4 •5h2SOIT. Auteur: Smokefoot. Source: Wikimedia Commons. Le CU2+ (les sphères orange) est simultanément coordonnée avec des molécules de 4 h2O (oxygène = rouge; hydrogène = blanc) et avec 2 atomes d'oxygène du SOS42- (soufre = jaune). Dans la figure une des molécules H2O Il est en liberté apparente mais fait partie de la structure cristalline.
Nomenclature
 Minéral de Chalcantita Cuso4 •5h2SOIT. Auteur: Archaeodontosaurus. Source: Wikimedia Commons.
Minéral de Chalcantita Cuso4 •5h2SOIT. Auteur: Archaeodontosaurus. Source: Wikimedia Commons. - Pentahydrate de cuivre sulfate
- Souffrance en cuivre (ii) pentahydrate
- Bluejack
- Pierre bleue (anglais Pierre bleue)
- Chalcantita, calcantita, chalclasa ou calclasa
Propriétés
État physique
Solide cristallin bleu.
Poids moléculaire
249 686 g / mol
Point de fusion
En atteignant 110 ºC, il se décompose.
Densité
2 286 g / cm3
Solubilité
Eau soluble: 22,0 g / 100 g d'eau à 25 ° C. Méthanol soluble (choisissez3OH). Légèrement soluble dans l'éthanol (choisissez3Ch2OH).
Propriétés chimiques
Ce composé lorsqu'il entre en contact avec l'eau est dissous en formant les ions Cu2+ Et ainsi42-. Sa solubilité dans l'eau diminue considérablement si l'acide sulfurique est présent dans l'eau.
Il peut vous servir: alcool camphore: structure, formule, propriétés et utilisationsLe H2Swin4 Fournit des ions SO42- Et sa présence génère l'effet de "l'ion commun", car cet ion est présent dans le sulfate de cuivre pentahydraté. La dissolution peut être exprimée comme suit:
Cuso4 •5h2Ou (solide) + eau ⇔ Cu2+ + Swin42- + eau
Par conséquent, si le SO est déjà présent en solution42- de l'acide sulfurique, l'équilibre se déplace vers la gauche, c'est-à-dire vers la formation du solide et donc la solubilité diminue.
Obtention
L'une des façons d'obtenir du sulfate de cuivre pentahydrate est de dissoudre le minéral de la malachite en solution aqueuse d'acide sulfurique (H2Swin4) à température contrôlée. La malvita contient Cu2(OH)2CO3 Avec d'autres impuretés, comme le fer.
La solution impure du cuivre (II) est traitée avec du peroxyde d'hydrogène (H2SOIT2) pour s'assurer que les impuretés de fer (ii) (foi2+) devenir le fer (iii) (foi3+). Ce dernier est fait sous forme d'hydroxyde ferrique (Faith (OH)3) en utilisant de l'hydroxyde de sodium (NaOH).
Un précipité signifie que des particules d'un solide insoluble se forment dans la solution, qui tombe au fond du récipient qui le contient.
 Apparence d'une solution CUSO concentrée4 •5h2SOIT. Auteur: DomainPartures publiques. Source: Pixabay.
Apparence d'une solution CUSO concentrée4 •5h2SOIT. Auteur: DomainPartures publiques. Source: Pixabay. Le mélange résultant est filtré pour éliminer le solide de foi (OH)3 Et le liquide restant est traité avec de l'éthanol (C2H5Oh), méthanol (choisissez3Oh) ou de l'acide sulfurique pour précipiter tous les ions Cu2+ Cuo4 •5h2SOIT.
Lors de l'ajout par exemple de l'éthanol, il y a moins d'eau disponible pour les ions Cu2+ Et ainsi42- sont en solution et ont tendance à se réunir. Agit comme une déshydratation. Plus il est ajouté d'éthanol plus solide.
Le solide précipité peut être recrit pour le purifier. Pour ce faire, il se dissout dans l'eau à une température de 80-90 ° C, puis la solution se refroidit à 25-30 ° C. Le composé du pentahydrate se précipite à nouveau et les impuretés restent en solution.
Applications
A un large intervalle d'applications commerciales.
Dans le domaine de l'agriculture, il sert de pesticide, insecticide, herbicide, fongicide, germicide et additif du sol. Dans les thérapies vétérinaires, il est utilisé comme antihelmintitique, fongicide et émético (pour provoquer des vomissements).
Il est utilisé comme pigment bleu ou vert dans les colorants et les colorants, comme un mordant dans la couleur des tissus et des métaux. Également comme un toner d'impression sur les photographies et comme réactif pour intensifier les négatifs.
Peut vous servir: charge nucléaire efficaceIl est utilisé dans les activités minières comme réactif de flottaison pour le zinc et la récupération de plomb. Il sert à produire d'autres composés de cuivre, il est utilisé dans le bronzage.
Dans la nourriture pour les animaux
Ce composé est utilisé dans l'alimentation des porcs en très petites quantités en tant que promoteur de croissance, en particulier dans la phase postérieure. Le mécanisme par lequel il a cet effet est encore inconnu.
Certains chercheurs affirment qu'il réduit la population de bactéries pathogènes ou nocives dans l'intestin des animaux et favorise par conséquent leur croissance.
 Avec le cuso4 •5h2O Vous pouvez favoriser le développement de porcs sevrés. Auteur: Mabelamber. Source: Pixabay.
Avec le cuso4 •5h2O Vous pouvez favoriser le développement de porcs sevrés. Auteur: Mabelamber. Source: Pixabay. D'autres chercheurs indiquent qu'il améliore la santé de l'intestin de ces animaux, mais certaines recherches indiquent que l'injection intraveineuse en cuivre améliore également sa croissance.
Il a également été utilisé dans le même but dans la volaille et a été utilisé dans la carence en cuivre des ruminants.
Dans la synthèse des nanoparticules
Le sulfate de cuivre à la pentahydrate a été utilisé pour obtenir des nanoparticules de cuivre mixtes et de l'oxyde de cuivre (I) (Cu / Cu2SOIT).
Les nanoparticules sont des structures extrêmement petites qui ne peuvent être vues que par un microscope électronique.
Poussière Cu / Cu2O Sous forme de nanoparticules, il a utilisé dans la catalyse ou l'accélération des réactions chimiques, dans les semi-conducteurs et dans les matériaux antimicrobiens, entre autres applications.
Dans des études pour la lutte antiparasitaire
Le cuso4 •5h2Ou il a été utilisé dans les expériences pour évaluer sa toxicité envers les escargots de l'espèce Pomacea canaliculata.
Ce sont des mollusques indigènes des régions tropicales d'Amérique du Sud qui habitent divers types d'écosystèmes, des marécages et des lagunes aux lacs et aux rivières.
Ils sont étudiés parce que certains parasites humains hébergent comme le Schistosoma Mansoni (Trematode qui produit la maladie de Bilharzia). Les caracoles peuvent également être nocifs pour les cultures agricoles des régions inondées.
 Caparazones de los caracoles Pomacea canaliculata. H. Zell / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons.
Caparazones de los caracoles Pomacea canaliculata. H. Zell / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons.  Œufs déposés par les escargots dans une plante aquatique. Ces escargots constituent parfois une peste qui peut être contrôlée avec le cuso4 •5h2SOIT. Shan LV, Institut national des maladies parasites / CC par (https: // CreativeCommons.Org / licences / par / 2.5). Source: Wikimedia Commons.
Œufs déposés par les escargots dans une plante aquatique. Ces escargots constituent parfois une peste qui peut être contrôlée avec le cuso4 •5h2SOIT. Shan LV, Institut national des maladies parasites / CC par (https: // CreativeCommons.Org / licences / par / 2.5). Source: Wikimedia Commons. Selon les études examinées, les solutions aqueuses de sulfate de cuivre pentahydrate sont extrêmement toxiques pour ces escargots, de sorte que ce composé peut être utilisé pour éliminer le mollusque des zones infestées.
Peut vous servir: réactions de combustionSelon certaines enquêtes, c'est parce que l'escargot n'a pas besoin de l'ion cuivre, donc le simple contact avec cet ion serait suffisant pour que la mort de l'animal se produise.
Dans les tissus conducteurs électriques
Ce composé a été utilisé pour obtenir des matériaux textiles avec des capteurs d'électricité intégrés. Ce type de tissu a une application dans des dispositifs de stockage d'électricité, des capteurs de pression, un photodétecteur et des écrans d'émission de lumière.
Pour obtenir des tissus conducteurs d'électricité, une fibre métallique de cellulose tissée de cellulose appelée "lyocell" est recouverte de cuivre métallique. Le revêtement est effectué de manière non électrolytique basée sur une solution de CUSO4 • 5H2O et d'autres composés chimiques auxiliaires.
 Fibre de lyocell. Ce type de tissu a été utilisé dans les tests de revêtement en cuivre. Dobrozhinetsky / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons.
Fibre de lyocell. Ce type de tissu a été utilisé dans les tests de revêtement en cuivre. Dobrozhinetsky / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons. Le tissu obtenu de cette manière peut transférer un signal électrique même dans des conditions de déformation ou d'étirement en maintenant une conductivité élevée.
Effets sur l'environnement
Comme expliqué ci-dessus le cuso4 •5h2Ou lors de la dissolution dans l'eau génère l'ion cuivre (II).
Bien que le cuivre soit essentiel à de faibles concentrations pour les activités cellulaires des organismes vivants, à des concentrations élevées, elle peut être toxique et même provoquer la mort.
Par conséquent, la présence de cet ion dans l'environnement constitue un risque pour les animaux et les plantes. Dans les écosystèmes aquatiques, il peut être bioacumulé chez les êtres vivants et dans la chaîne alimentaire, causant des dommages.
 Le cuso4 •5h2O Cela peut être nocif pour les environnements aquatiques. Auteur: Jamesdemers. Source: Pixabay.
Le cuso4 •5h2O Cela peut être nocif pour les environnements aquatiques. Auteur: Jamesdemers. Source: Pixabay. En fait, dans certaines expériences, il a été constaté que la contamination des environnements aquatiques avec du sulfate de cuivre pentahydrate provoque que la biomasse de certaines plantes aquatiques diminue.
Ce qui signifie que les plantes poussent moins en présence de ce sel à des concentrations élevées.
Les références
- Diriger, D.R. (éditeur) (2003). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- Kokes, H. et al. (2014). Dissolution du cuivre et du fer à partir du minerai de malachite et de la précision du pentahydrate de sulfate de cuivre par processus chimique. Sciences et technologie de l'ingénierie, une revue internationale. 2014; 17 (1): 39-44. Récupéré de ScienceDirect.com.
- Azevedo b alves., J.P. et peixoto, m.N. (2015). Réduction de la biomasse de Salvinia ennuyeuse Exposé au pentahydrate de sulfate de cuivre (Cuo4.5h2SOIT). Tour. Ambiant. Water 2015; 10 (3): 520-529. Récupéré de Doaj.org.
- Racine, w. et al. (2019). Capteur de déformation textile flexible basé sur un tissu de cellulose en cuivre en cuivre. Polymers 2019, 11, 784. MDPI a récupéré.com.
- Pitelli, R.POUR. et al. (2008). Toxicité aiguë du sulfate de cuivre et de l'extrait aqueux des feuilles de neem séchées sur les escargots (Pomacea canaliculata). SCI ACT. Biol. SCI. 2008; 30 (2): 179-184. Récupéré de Doaj.org.
- Badawy, s.M. et al. (2015). Synthèse, caractérisation et activité catalytique des nanoparticules Cu / Cu2O préparées dans un milieu aqueux. Bulletin d'ingénierie et de catalyse de la réaction chimique. 2015; 10 (2): 169-174. Récupéré de Doaj.org.
- Justel, F.J. et al (2014). Solubilités et propriétés physiques des solutions saturées dans le sulfate de cuivre + acide sulfurique + système d'eau de mer à différentes températures. Journal brésilien en génie chimique. 2015; 32 (3): 629-635. Récupéré de Doaj.org.
- Park, C.S. Et Kim, B.g. (2016). In vitro Solubilité du cuivre (II) sulfate et trihydroxyde de chlorure de dicopper pour les porcs. Austalas asiatique. J. Animation. SCI. 2016; 29 (11): 1608-1615. Récupéré de Doaj.org.
- OU.S. Bibliothèque nationale de médecine. (2019). Pentahydrate de sulfate de cuivre. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Wikipedia (2020). Chalcanthite. Récupéré de.Wikipédia.org.
- « Caractéristiques des biomas marins, types, flore, faune
- Cix (biologique) Structure, propriétés, fonction, types »

