SGLT (protéines de transport sodium-glucose)
- 2765
- 681
- Prof Noah Collet
Le Protéines de transport de sodium-glucose (SGLT) Ils sont responsables de l'efficacité du transport actif du glucose dans les cellules de mammifères contre un gradient de concentration. L'énergie requise pour rendre ce transport possible est acquise à partir du cotransport de sodium dans la même direction (SIMPORT).
Son emplacement est limité à la membrane des cellules qui forment les tissus épithéliaux responsables de l'absorption et de la réabsorption des nutriments (intestin mince et tubule profilé proximal du rein).
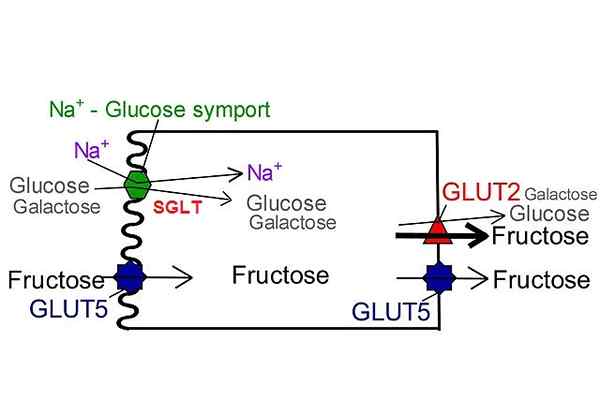
 Transporteurs de glucose SGLT Contrairement à GLUT. Par NUFS, San Jose State University [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)], modifié de Wikimedia Commons.
Transporteurs de glucose SGLT Contrairement à GLUT. Par NUFS, San Jose State University [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)], modifié de Wikimedia Commons. À ce jour, seules six isoformes appartenant à cette famille de transporteurs ont été décrites: SGLT-1, SGLT-2, SGLT-3, SGLT-4, SGLT-5 et SGLT-6. Dans chacun d'eux, le courant électrochimique généré par le transport de l'ion sodium fournit de l'énergie et induit le changement de conformation de la structure de la protéine nécessaire pour transloquer le métabolite de l'autre côté de la membrane.
Cependant, toutes ces isoformes diffèrent les unes des autres en présentant des différences dans:
- Le degré d'affinité qu'ils ont pour le glucose,
- La capacité de réaliser du glucose, du galactose et du transport d'acides aminés,
- Le degré auquel ils sont inhibés par Florizina et
- L'emplacement des tissus.
[TOC]
Mécanismes moléculaires du transport du glucose
Le glucose est un monosaccharide de six atomes de carbone qui est utilisé par la plupart des types de cellules existants pour obtenir l'énergie par des voies d'oxydation métabolique.
Compte tenu de sa grande taille et de sa nature essentiellement hydrophilite, il est incapable de traverser les membranes cellulaires par diffusion libre. Par conséquent, sa mobilisation du cytosol dépend de la présence de protéines de transport dans ces membranes.
Les transporteurs de glucose jusqu'à présent étudiés effectuent le transport de ce métabolite par des mécanismes de transport passifs ou actifs. Le transport passif diffère du transport actif dans lequel il ne nécessite pas une alimentation énergétique, car il se produit en faveur d'un gradient de concentration.
Il peut vous servir: épiderme de l'oignonLes protéines impliquées dans le transport passive du glucose appartiennent à la famille des bouts de transporteurs disséminés disséminés, ainsi appelés par l'acronyme en anglais du terme "transporteurs de glucose". Alors que ceux qui en effectuent un transport actif ont été appelés SGLT par des "protéines de transport de glucose sodium-glucose".
Ces derniers obtiennent l'énergie libre nécessaire pour effectuer le transport du glucose contre son gradient de concentration du cotransport de sodium. Au moins 6 isoformes SGR ont été identifiées et son emplacement semble être limité aux membranes des cellules épithéliales.
Caractéristiques SGLT
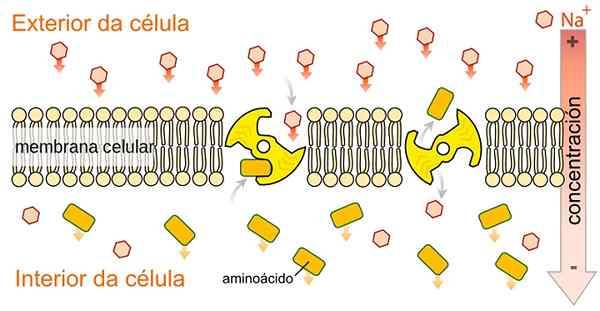 Les entraîneurs SLGT SIMPORT ne sont pas spécifiques au glucose, ils sont capables de transporter une autre variété de métabolites tels que les acides aminés, le galactose et d'autres métabolites, car ils utilisent l'énergie libérée par le cotransport en ion sodium en faveur de leur gradient de concentration. Par speciladyofhats [cc0 (https: // CreativeCommons.Org / licences / by-sa / 4.0), de Wikimedia Commons.
Les entraîneurs SLGT SIMPORT ne sont pas spécifiques au glucose, ils sont capables de transporter une autre variété de métabolites tels que les acides aminés, le galactose et d'autres métabolites, car ils utilisent l'énergie libérée par le cotransport en ion sodium en faveur de leur gradient de concentration. Par speciladyofhats [cc0 (https: // CreativeCommons.Org / licences / by-sa / 4.0), de Wikimedia Commons. Comme indiqué par son nom, les protéines de transport de sodium-glucose effectuent le type de sodium et de glucose ou de sodium et le cytosol de type sodium et de galactose au cytosol cellulaire.
Le transport de sodium en faveur d'un gradient de concentration est responsable de la génération d'énergie libre indispensable pour mobiliser le glucose d'une zone de concentration à faible concentration à une concentration élevée.
Ces transporteurs font partie d'un groupe de protéine anti-transport et de sympathie du sodium et de l'hydrogène dont les gènes ne sont pas liés phylogénétiquement.
Son emplacement est limité à la membrane luminale des cellules épithéliales des tissus impliqués dans l'absorption des nutriments, tels que l'intestin mince et le tubule profilé proximal.
Peut vous servir: coxiella burnetiiTypes SGLT
À ce jour, six transporteurs SGLT (SGLT-1, SGLT-2, SGLT-3, SGLT-4, SGLT-5 et SGLT-6) ont été identifiés. Tous montrent des différences dans la préférence de transport du glucose ou du galactose, l'affinité qu'ils présentent pour ces sucres et le sodium et par le fait de pouvoir être inhibé par Florizina.
SGLT1 a la capacité de transporter le galactose en plus du glucose avec une cinétique très similaire, tandis que SGLT2 ne transporte que le glucose.
Structure GSLT
La longueur de la séquence peptidique des protéines SGLT varie de 596 à 681 déchets d'acides aminés. Pendant ce temps, les pourcentages d'homologie entre les séquences varient entre 50 et 84% par rapport à SGLT-1, étant le plus grand degré de divergence dans les séquences qui correspondent au domaine extracellulaire amino terminal et terminal carboxyle.
La structure générale coïncide avec celle d'une protéine intégrale multipaso, c'est-à-dire qu'elle traverse la membrane plusieurs fois à travers des domaines transmembranaires riches en acides aminés hydrophobes.
Ces domaines transmembranaires sont 14 au total et chacun a une structure secondaire α-hélice. Les segments 1, 2, 5, 7 et 9 sont organisés spatialement en position centrale, ce qui donne naissance à la formation de pores hydrophiles.
À travers les transits de pores hydrophiles, ainsi que n'importe lequel des autres métabolites pour lesquels le transporteur peut avoir une affinité. Les fragments hélicoïdaux restants sont organisés en parallèle pour conférer une plus grande stabilité structurelle au canal.
Fonctions SGLT
Les membres de la famille SGLT ne montrent pas une spécificité unique pour le glucose. Au contraire, ils sont capables de se mobiliser activement à travers la membrane des cellules tubulaires rénales et l'épithélium intestinal une grande variété de métabolites tels que les acides aminés, les ions, le glucose et les osmolytes.
La fonction de ce type de transporteurs qui a été plus largement étudiée est la réabsorption du glucose présent dans l'urine.
Il peut vous servir: Embryologie comparative: qu'est-ce que c'est, quelles études, histoire, théoriesCe processus de réabsorption implique la mobilisation des glucides des tubules rénaux à travers des cellules d'épithélium tubulaires à la lumière des capillaires péritubulaires. Étant l'isoforme de grande capacité et affinité pour le glucose SGLT-2, qui est le principal contribuable.
La fonction d'absorption du glucose dans le tractus intestinal est attribuée à SGLT-1, un convoyeur qui, malgré une faible capacité, a une forte affinité pour le glucose.
Le troisième membre de cette famille, SGLT3, est exprimé dans les membranes des cellules musculaires squelettiques et du système nerveux, où il ne semble pas agir comme un transporteur de glucose mais comme un capteur des concentrations de ce sucre dans le milieu extracellulaire.
Les fonctions des isoformes SGLT4, SGLT5 et SGLT6 n'ont pas été certains jusqu'à présent.
Les références
- Abramson J, Wright Em. Structure et fonction des symporteurs NA avec des répétitions inversées. Curr Ace Struct Biol. 2009; 19: 425-432.
- Alvarado F, Crane RK. Études sur le mécanisme de l'absorption intestinale des sucres. Vii. Transport du phénylgllycoside et sa relation possible avec l'inhibitation de la phorizine du transport d'activités des sugs par le petit inscripteur. Biochim Biophys Act. 1964; 93: 116-135.
- Charron FM, Blanchard MG, Lapointe JY. L'hypertonicité intracellulaire est responsable du flux d'eau associé au cotransport NA_ / Glycose. Biophys J. 2006; 90: 3546-3554.
- Chen XZ, Coady MJ, Lapointe JY. Discles de serrage à tension rapide vers un nouveau composant des courants à l'état perparky du cotransporteur NA_-Glucose. Biophys J. mille neuf cent quatre vingt seize; 71: 2544-2552.
- Dyer J, Wood Is, Palejwala A, Ellis A, Shirazi-Beechey SP. Expression des transporteurs monosaccharides dans l'intestin des humains diabétiques. Am J Physiol Gastroirost Liver Physiol. 2002; 282: G241-G248.
- Sátk M, Marks J, Unwin RJ. Emplacement et fonction des tissus putatifs du membre de la famille SLC5 SGLT3. Exp Physiol. 2017; 102 (1): 5-13.
- Turk E, Wright Em. Motifs de topologie membranaire dans la famille des cotransporteurs SGG. J Memb Biol. 1997; 159: 1-20.
- Turk E, Kim O, Him J, Whitelegge JP, Eskandari S, Lam JT, Kreman M, Zampighi G, Faull KF, Wright EM. Caractérisation moléculaire de Vibrio parahaemolyticus VSGLT: un modèle de cotransporteurs de sucre couplé au sodium. J Biol Chem. 2000; 275: 25711-25716.
- Taroni C, Jones S, Thornton JM. Analyse et prédiction des sites de liaison des glucides. Protéine ENG. 2000; 13: 89-98.
- Wright Em, Loo DD, Hirayama BA. Biologie des transporteurs de glucose de sodium humain. Physiol Rev. 2011; 91 (2): 733-794.
- « Caractéristiques de la magnétosphère terrestre, structure, gaz
- Éléments de déclin magnétique et champ magnétique de la Terre »

