Caractéristiques de Takera, structure, fonctions
- 2941
- 900
- Adrien Remy
La Sakera, Également connu sous le nom de complexe tabera-isomaltase, il s'agit d'un complexe enzymatique membranal avec une activité α-glycosylase appartenant au groupe d'hydrolases complètes (composée de glycosidases et de peptidases).
Il est présent dans les micrages intestinaux de nombreux animaux terrestres tels que les mammifères, les oiseaux et les reptiles. Selon différentes sources bibliographiques, d'autres noms acceptés de cette enzyme sont l'oligo-1,6-glucosidase, l'α-méthyl glucosidase, l'isomaltase et l'oligosaccharide α-1,6-glucosidase.
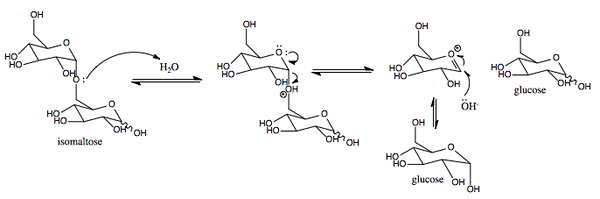
 Représentation graphique du mécanisme d'action des Sacas.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons)
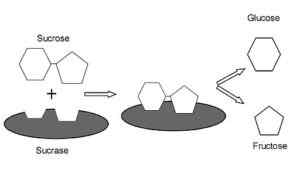
Représentation graphique du mécanisme d'action des Sacas.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons) Il s'agit d'une enzyme avec une activité similaire à l'inverse a été trouvée dans les plantes et les micro-organismes. Sa fonction principale est d'hydrolyser la liaison glucosidique entre les monosaccharides (glucose et fructose) qui composent le saccharose ingéré de nourriture.
Il a des fonctions digestives très importantes, car le saccharose ne peut pas être transporté comme disaccharide dans les cellules intestinales et, par conséquent, son hydrolyse permet l'absorption intestinale de ses monosaccharides constitutifs.
La synthèse et l'activité de l'isomaltase des prétendants dans les cellules intestinales des animaux sont régulées à plusieurs niveaux: pendant la transcription et la traduction, pendant la glycosylation et aussi pendant son traitement post-traductionnel.
Lorsque l'un de ces événements échoue ou un type de mutation se produit dans le gène qui le code, chez l'homme, il existe une condition pathologique connue sous le nom de syndrome de carence en saccharose, qui est liée à l'impossibilité de métaboliser les disaccharides.
[TOC]
Caractéristiques
Les disaccharides qui servent de substrat aux mammifères chez les mammifères sont généralement le produit de l'activité hydrolytique des enzymes salivaires et pancréatiques α-amylases. Cela est dû au fait que les SACAS hydrolysent non seulement les liaisons glucosidiques du saccharose, mais aussi les liaisons α-1,4 du maltose et du maltotriosa et d'autres oligosaccharides.
La demi-vie du même varie entre 4 et 16 heures, donc les cellules intestinales investissent beaucoup.
Peut vous servir: quelle est la création? (La biologie)La synthèse
Comme les enzymes hydrolases les plus complètes, les sackwaters (prétendant-isomaltase ou oui) est une glycoprotéine synthétisée dans les cellules de bord de la brosse telles qu'un précurseur polypeptidique dénoté pro-if.
Cette molécule précurseur est transportée vers la surface apicale des cellules et il est traité enzymatiquement par des protéases pancréatiques qui la divisent en deux sous-unités différentes: la sous-unité isomaltase et la subnidad subnidad.
La sous-unité d'isomaltase correspond à l'extrémité amino terminale du pro-si et a un segment hydrophobe (ancre hydrophobe) à son extrémité N-terminale. Cela vous permet de vous associer à la membrane plasmique des cellules intestinales au bord de la brosse.
Le gène qui code ce complexe chez l'homme est situé dans le long bras du chromosome 3 et étant donné la grande homologie de la séquence entre les deux sous-unités (plus de 40%), il a été suggéré que cette enzyme est née à travers un événement de duplication génétique.
Il a été prouvé que les deux sous-unités, l'isomaltase et les sacas sont capables d'hydrolyz.
Structure
La forme initiale de l'enzyme sacas, le polypeptide pro-si, a environ 260 kDa et 1827 acides aminés. Cependant, l'activité protéolytique des protéases pancréatiques produit deux sous-unités de 140 kDa et 120 kDa, qui représentent l'isomaltase et les sacaras, respectivement.
Cette enzyme est une glycoprotéine avec des parties saccharidés N- et SOIT-Les glycosiladas et les études de leur séquence révèlent la présence de plus de 19 sites de glycosylation. Les portions de glucides représentent plus de 15% du poids de la protéine et sont essentiellement composées d'acide sinalique, de galactosamine, de main et de N-acétylglucosamine.
Peut vous servir: leucine: caractéristiques, structure, fonctions, biosynthèseÉtant donné que les deux sous-unités du complexe sacrase-isomaltase ne sont pas exactement les mêmes, de nombreux auteurs considèrent que cette enzyme est, en réalité, un hétérodimère où chaque sous-unité se compose d'une chaîne polypeptidique linéaire glycosylée et qu'elle est associée à des liens non covalents.
La sous-unité isomaltase a un segment hydrophobe de 20 déchets d'acides aminés impliqués dans son association avec la membrane des entérocytes (cellules intestinales) et qui représentent une ancre permanente et un signal peptidique pour aller au réticulum endoplasmique.
Le site actif des deux sous-unités, Sacas et isomaltase, se trouve dans la membrane plasmique des entérocytes, dépassant vers la lumière intestinale.
Les fonctions
Les principales fonctions métaboliques des enzymes telles que le prétendant-isomaltase sont liées à la production de glucose et de fructose à partir de saccharose. Monosaccharides transportés dans des cellules intestinales et qui sont incorporées dans différentes routes métaboliques à des fins différentes.
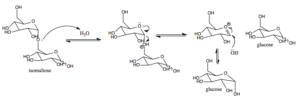 Mécanisme d'action de la sucre-isomaltase chez les mammifères (Source: AREID3 [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons)
Mécanisme d'action de la sucre-isomaltase chez les mammifères (Source: AREID3 [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons) Le glucose, pour lequel il existe des transporteurs spécifiques, peut être dirigé par voie intracellulaire vers la glycolyse, par exemple, où son oxydation conduit à la production d'énergie sous forme d'ATP et réduisant la puissance sous forme de NADH.
Le fructose, en revanche, peut également être métabolisé par une série de réactions qui commencent par sa phosphorylation en fructose 1-phosphate et catalysée par une fructochinase hépatique. Cela commence l'inclusion de ce substrat à d'autres voies de production d'énergie.
De plus, comme avec l'enzyme inversée dans les plantes, l'activité sucre-isomaltase a des implications importantes dans des aspects cellulaires tels que la pression osmotique, qui conditionnent généralement les événements physiologiques tels que la croissance, le développement, le transport de molécules et d'autres.
Maladies liées à l'homme
Il existe une maladie autosomique congénitale chez l'homme appelé prétendant-isomaltasa ou carence en CSID (anglais Déficity congénitale de Lindy-Isomaltase), qui est lié à des défauts dans les disaccharides de digestion aux oligo et de disaccharides actifs.
Peut vous servir: effet fondateurCette maladie a à voir avec plusieurs facteurs simultanés, parmi lesquels la poursuite incorrecte de la forme précurseur pro-si de l'enzyme, des mutations génétiques, des erreurs pendant le transport, etc.
Cette condition est difficile à diagnostiquer, étant souvent confondue avec une intolérance au lactose. Par conséquent, il est également connu sous le nom de "intolérance au saccharose".
Il se caractérise par le développement de crampes abdominales, de diarrhée, de vomissements, de jaquecas accompagnés d'hypoglycémie, de manque de croissance et de gain de poids, d'anxiété et de production excessive de gaz.
Les références
- Brunner, J., Hauser, H., Braun, h., Wilson, K., Wecker, W., O'Neill, b., & Semenza, g. (1979). Le mode d'association de la lygase-isomaltase complexe enzymatique avec la membrane de bordure de la brosse intestinale. Le Journal of Biological Chemistry, 254(6), 1821-1828.
- Cowell, G., Tranum-Jensen, J., Sjöström, H., & Norén, ou. (1986). Topologie et structure quaternaire de la pro-sucrase / isomaltase et de la forme finale Simured / Isomaltase. Journal biochimique, 237, 455-461.
- Hauser, H., & Semenza, g. (1983). Limade-isomaltase: une protéine intrinsèque traquée de la membrane de la bordure de la brosse. Critiques critiques dans Bioch, 14(4), 319-345.
- Hunziker, W., Spiesss, m., Semenza, G., & Lodish, H. F. (1986). Le complexe Limade-Lsomaltase: structure primaire, orientation de la membrane et évolution d'une protéine de bordure de pinceau intrinsèque et harcelée. Cellule, 46, 227-234.
- Naim, h. ET., Roth, J., Sterchi, E. ET., Lentze, m., Mile, P., Schmitz, J., & Hauril, H. (1988). Déficity de Lind-Isomaltase chez l'homme. J. Lutter. Investir., 82, 667-679.
- Rodriguez, je. R., Taravel, F. R., & Whelan, W. J. (1984). Caractérisation et fonction de la linde-isomaltase intestinale de porc et de ses sous-unités distinctes. EUR. J. Biochimie., 143, 575-582.
- Schiweck, h., Clarke, m., & Pollach, G. (2012). Sucre. Dans Encyclopédie de la chimie industrielle d'Ullmann (Vol. 34, P. 72). Wiley-VCH Verlag GmbH & Co. Kgaa.
- Treem, W. (Année mille neuf cents quatre-vingts-quinze). Déficity congénitale de Lindy-Isomaltase. Journal of Pediatric Gastroenterology and Nutrition, vingt-et-un, 1-14.
- « Caractéristiques de la gastrine, structure, production, fonctions
- Les 11 principaux types d'ingénierie et leurs caractéristiques »

