Qu'est-ce que la corrosion et comment l'éviter?

- 3200
- 166
- Eva Henry
 Métal corrodé
Métal corrodé Qu'est-ce que la corrosion?
Pour savoir Comment éviter la corrosion Il est important de savoir ce qu'est la corrosion et pourquoi elle se produit. Le processus naturel est appelé corrosion dans lequel un métal se détériore progressivement à la suite de réactions électrochimiques (ou chimiques) avec son environnement.
Ces réactions font que les métaux raffinés ont l'air. La corrosion se produit également dans des matériaux non métalliques tels que la céramique et les polymères, mais il est différent et est généralement appelé dégradation.
La corrosion est un processus ennemi de l'être humain, car ces dommages dégradent les matériaux, changent de coloration et les affaiblissent, augmentant la possibilité de rupture et d'augmentation des coûts par réparation et en remplacement.
Pour cette raison, il existe des domaines entiers dans la science des matériaux dédiés à la prévention de ce phénomène, comme l'ingénierie de la corrosion. Les méthodes de prévention de la corrosion sont variées et dépendront des matériaux affectés.
Méthodes pour éviter la corrosion
Premièrement, il convient de prendre en compte que tous les métaux ne fonctionnent pas à la même vitesse, et certains ont la particularité de ne pas se corroder naturellement, comme dans le cas de l'acier inoxydable, de l'or et du platine.
Cela se produit parce qu'il existe des matériaux pour lesquels la corrosion est thermodynamiquement défavorable (c'est-à-dire qu'elles n'atteignent pas une plus grande stabilité avec les processus qui les mènent) ou parce qu'ils ont une réaction cinétique si lente que les effets de corrosion prennent du temps à montrer.
Peut vous servir: bleu bromotimolMême ainsi, pour les éléments qui se déroulent, il existe une série de méthodes pour empêcher ce processus naturel et leur donner plus de vie:
Galvanisé
Il s'agit de la méthode de prévention de la corrosion dans laquelle un alliage de fer et d'acier avec une fine couche de zinc est couvert. L'objectif de cette méthode est de faire en sorte que les atomes de zinc du revêtement réagissent avec les molécules d'air, oxydant et retardant la corrosion de la pièce qu'ils couvrent.
Cette méthodologie fait du zinc une anode galvanique ou un sacrifice de l'anode, ce qui le fait exposer à la dégradation de la corrosion pour sauver un matériau plus précieux.
Le galvanisé peut être obtenu par immersion des pièces métalliques dans le zinc fondu à des températures élevées, ainsi que dans des couches plus minces qui sont obtenues avec l'électrogalvanisation.
Ce dernier est la méthodologie qui protège davantage, car le zinc est lié au métal par des processus électrochimiques et pas seulement par des processus mécaniques comme en immersion.
Peintures et couverture
L'application de peintures, de plaques métalliques et d'émaux est une autre façon d'ajouter une couche protectrice aux métaux de la corrosion. Ces substances ou couches génèrent une barrière de matériau anticorrosif qui est apporté entre l'environnement nocif et le matériau structurel.
D'autres couvertures ont des propriétés spécifiques qui en font la corrosion ou les inhibiteurs anticorrosifs. Ceux-ci sont d'abord ajoutés aux liquides ou aux gaz, puis ils sont ajoutés sous la forme d'un métal sur le métal.
Ces composés chimiques sont considérablement utilisés dans l'industrie, en particulier dans les tuyaux qui transportent des liquides; De plus, ils peuvent être ajoutés à l'eau et aux réfrigérants pour s'assurer qu'ils ne génèrent pas de corrosion dans l'équipement et les tuyaux à travers lesquels ils passent.
Peut vous servir: principe aufbauAnodisation
Il s'agit d'une procédure de passivation électrolytique; c'est-à-dire le processus par lequel un film quelque peu inerte se forme à la surface d'un élément métallique. Ce processus est utilisé pour augmenter l'épaisseur de la couche d'oxyde naturel que ce matériau a à sa surface.
Ce processus a le grand avantage non seulement d'ajouter une protection contre la corrosion et le frottement, mais offre également une plus grande adhérence pour les couches de peinture et de colle que le matériau découvert.
Bien qu'il ait connu des changements et des évolutions au fil du temps, ce processus est couramment effectué en introduisant un objet en aluminium dans une solution électrolytique et en passant un courant direct à travers ce.
Ce courant entraînera la libération de l'anode en aluminium à libérer de l'hydrogène et de l'oxygène, générant de l'oxyde d'aluminium qui le rejoindra pour augmenter l'épaisseur de sa couche superficielle.
L'anodisation génère des changements dans la texture microscopique de la surface et dans la structure cristalline du métal, provoquant une forte porosité.
Par conséquent, malgré l'amélioration de la résistance et de la résistance à la corrosion métallique, elle peut également la rendre plus fragile, en plus de réduire sa résistance à des températures élevées.
Biipels
Les biinels sont des groupes de micro-organismes qui se lient sous la forme d'une couche sur une surface, se comportant comme un hydrogel mais représentant toujours une communauté vivante de bactéries ou d'autres micro-organismes.
Bien que ces formations soient généralement associées à la corrosion, ces dernières années, il y a eu un développement dans l'utilisation de biofilms bactériens pour protéger les métaux dans des environnements hautement corrosifs.
Il peut vous servir: relation de chimie avec d'autres sciencesDe plus, des biofilms aux propriétés antimicrobiens ont été découverts, ce qui arrête les effets de la réduction des bactéries du sulfate.
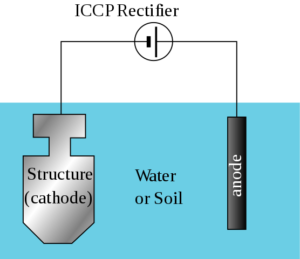
Courants imprimés
Dans ces très grandes structures ou où la résistivité de l'électrolyte est élevée, les anodes galvaniques ne peuvent pas générer suffisamment de courant pour protéger toute la surface, de sorte qu'un système de protection cathodique est utilisé par des courants imprimés.
Ces systèmes se composent d'anodes connectées à une source d'alimentation de courant direct, principalement un récipiendaire de transformateur connecté à une source de courant alternative.
Cette méthode est principalement utilisée dans les cargos et autres navires, qui nécessitent un haut niveau de protection sur une plus grande surface de leur structure, tels que les hélices, les grossesses et autres pièces sur lesquelles la navigation dépend.
Changements dans les conditions environnementales
Enfin, le taux de corrosion peut s'arrêter ou réduire avec l'altération des conditions environnementales dans lesquelles le matériau métallique est situé.
L'humidité et le soufre, les chlorures et l'oxygène dans les liquides et les gaz doivent être maintenus à de faibles niveaux pour augmenter l'espérance de vie d'un matériau et utiliser moins de solution saline et / ou d'eau dure a un effet positif.
Les références
- Wikipédia. (s.F.). Corrosion. Obtenu à partir de.Wikipédia.org
- Équilibre, t. (s.F.). Protection contre la corrosion pour les métaux. Obtenu à partir de the balancage.com
- Eoncoat. (s.F.). Méthodes de prévention de la corrosion. Obtenu à partir d'eoncoat.com
- Metalspermarkets. (s.F.). Comment empêcher la corrosion. Obtenu à partir de métauxpermarkets.com
- Corrosionpedia. (s.F.). Protection cathodique actuelle imprimée (ICCP). Obtenu à partir de corrosionpedia.com