Principe du châtelier

- 2213
- 644
- Adrien Remy
Quel est le principe de Le Châtelier?
Il Principe du châtelier C'est une règle générale qui prédit l'effet que les différents facteurs qui affectent l'équilibre chimique ont. En particulier, il aide à prédire dans quelle direction une réaction qui est en équilibre se déplacera lorsque un tel équilibre sera perturbé par un agent externe.
Ce principe établit que:
"Lorsqu'un système en équilibre est soumis à une perturbation ou à une tension externe, le système réagit dans la direction qui lui permet de contrer partiellement de telles perturbations".
La perturbation est bien comprise:
- Un changement dans la concentration de l'un des réactifs.
- Un changement dans la concentration de l'un des produits.
- Changements de pression.
- Changements de volume.
- Un changement de température
Lorsque des changements se produisent comme ceux mentionnés, l'une des deux réactions, la directe ou l'inverse, est privilégiée par rapport à l'autre, de sorte que le système réagit en ce sens pour évoluer vers un nouvel état d'équilibre.
Ceci est similaire aux ajustements effectués par un équilibreur sur la corde raide. Lorsque Gravity Hala d'un côté, l'équilibreur réagit en se déplaçant du côté opposé. Nous disons que son équilibre a évolué, car il est toujours en équilibre (il ne tombe pas), mais maintenant il a une position différente.
Ensuite, nous verrons comment le principe du châtelier est utilisé pour prédire la direction dans laquelle un système réagira en souffrant différents types de tensions ou de perturbations telles que: les changements de concentration, de volume, de pression et de température.
Effet des changements de concentration
Supposons que nous ayons la réaction suivante en équilibre:
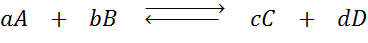
Si nous modifions la concentration de l'une des espèces impliquées (A, B, C ou D), le principe du châtelier prédit que le système réagira pour contrer ce changement, soit consommant l'excès ajouté, soit récupérant la quantité éliminée. 4 Des situations différentes peuvent être données:
1. Augmentation de la concentration de réactifs
Si nous augmentons la concentration d'un réactif, par exemple, à, selon le principe du châtelier, le système réagira pour consommer l'excès supplémentaire. Cela signifie qu'il réagira directement (de gauche à droite), car cette direction est consommée à.
Dans ce cas, il est dit que la réaction directe est favorisée et que l'équilibre s'est tourné vers les produits, car dans le nouveau solde, la concentration des produits est supérieure à celle de l'équilibre d'origine.
Peut vous servir: séparation magnétique2. Augmentation de la concentration de produits
Si nous augmentons la concentration d'un produit, par exemple, C, le système réagira à l'envers pour consommer l'excès C ajouté (c'est-à-dire de droite à gauche).
Dans ce cas, il est dit que la réaction inverse est favorisée et que l'équilibre se déplace vers les réactifs.
3. Diminution de la concentration réactive
La diminution de la concentration a l'effet inverse à l'augmentation de ladite concentration. Si nous nous retirons du milieu, réduisant ainsi sa concentration, le système réagira à la gauche (à l'envers) pour contrer le changement. L'équilibre se déplace vers les réactifs.
4. Diminution de la concentration des produits
Si nous diminuons la concentration de C ou D, le système réagira directement pour remplacer la concentration diminuée (c'est-à-dire de gauche à droite). L'équilibre se déplace vers les produits.
Exemple:
Déterminez l'effet de l'ajout d'ions tiociiens (SCN-) Dans l'équilibre chimique suivant, sachant que le produit de la droite est le rouge et le fer intenses (III) est jaune.
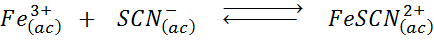
Solution: Dans ce cas, nous ajoutons Tiocianato qui est un réactif, donc l'équilibre doit se déplacer vers la droite, augmentant la concentration du complexe et, par conséquent, l'intensité de la couleur rouge dans la solution.
Effet des changements de volume et de pression
Les changements de volume et de pression n'affectent pas de manière significative les réactions de l'équilibre à l'état liquide ou solide, mais ils peuvent affecter ceux trouvés dans un état gazeux. En effet, pour les gaz, la concentration est proportionnelle à la pression, comme prévu par la loi idéale sur les gaz.
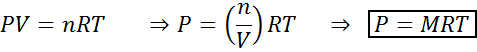
L'augmentation de la pression d'un gaz conservant la température constante est équivalente pour diminuer son volume, de sorte que l'effet des deux perturbations sera le même.
Si une pression totale augmente à une réaction d'équilibre dans les équilibres (ou si nous diminuons son volume), le système réagira en essayant de réduire à nouveau cette pression, de sorte que l'équilibre se déplacera là où il y a une plus petite quantité de molécules de particules gazeuses.
Peut vous servir: chromatographie en couche fine: caractéristiques, à quoi sert-elle Dans la réaction entre l'azote et l'hydrogène pour former de l'ammoniac, 4 molécules de soude sont consommées et seulement deux sont produites, donc une augmentation de la pression déplace l'équilibre vers la formation la plus d'ammoniac
Dans la réaction entre l'azote et l'hydrogène pour former de l'ammoniac, 4 molécules de soude sont consommées et seulement deux sont produites, donc une augmentation de la pression déplace l'équilibre vers la formation la plus d'ammoniac Si dans la réaction, ils sont consommés et le même nombre de molécules de gaz sont produites, les changements de volume et de pression n'affecteront pas l'équilibre.
D'un autre côté, si nous modifions uniquement la pression partielle de l'un des gaz, l'effet est le même que d'augmenter ou de diminuer la concentration de ces espèces.
Exemple:
Étant donné la réaction de décomposition du tétroxyde de dyitroge en équilibre:
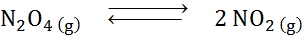
Déterminer l'effet de la réduction du volume, augmentant la pression.
Solution: Si nous augmentons la pression totale du système ou réduisons son volume, l'équilibre se déplace vers les réactifs, car, dans cette direction, il y a une diminution nette des molécules de gaz (2 et 1) sont consommées 1) qui permet de contrer l'augmentation de la pression.
Effet des changements de température
L'effet de la température sur l'équilibre chimique est différent des autres facteurs que nous avons vus jusqu'à présent. Dans les cas précédents, un nouvel équilibre est obtenu après la perturbation, mais la même constante d'équilibre est maintenue. Cependant, si la température change, la constante d'équilibre changera.
Pour savoir comment la constante d'équilibre change avec la température, le signe de l'enthalpie de réaction doit être connu:
- Si une réaction libère la chaleur, c'est-à-dire qu'elle est exothermique, son enthalpie est négative et la constante d'équilibre diminue à mesure que la température augmente. Dans ces cas, l'équilibre se déplace dans la direction opposée vers les réactifs.
- Si une réaction absorbe la chaleur, c'est-à-dire qu'elle est endothermique, son enthalpie est positive et l'inverse se produit.
Se souvenir de l'effet de la température est facile si nous considérons la chaleur comme un réactif qui se produit dans le cas des réactions exothermiques et est consommée dans le cas de l'endothermie. L'augmentation de la température serait comme "ajouter" de la chaleur au système et les refroidir serait équivalente pour le retirer.
Donc, si une réaction est exothermique et que la température augmente, ce serait comme ajouter un produit de la réaction, donc l'équilibre se déplace dans la direction opposée, vers les réactifs, et si elle refroidit l'opposé.
Il peut vous servir: acide píchric: qu'est-ce que la structure, la synthèse, les propriétésD'un autre côté, si une réaction est endothermique et que la température augmente, ce serait comme ajouter un réactif, donc l'équilibre se déplace vers les produits, tandis qu'une diminution de la température a l'effet inverse.
Exemple:
La réaction de décomposition de n2SOIT4 Il a une enthalpie de réaction de +58,0 kJ / mol. Dans quelle direction l'équilibre se déplacera si la température est diminuée?
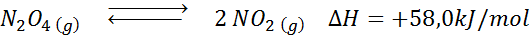
Solution: Comme l'enthalpie est positive, la réaction est endothermique. Pour cette raison, le refroidir favorisera la réaction inverse, et l'équilibre se déplacera vers les réactifs, c'est-à-dire vers la formation de plus n2SOIT4.
Effet des catalyseurs, des inhibiteurs et des substances inertes
Les catalyseurs et les inhibiteurs affectent la vitesse à laquelle les réactions se produisent, mais elles affectent à la fois la réaction directe et indirecte. Pour cette raison, ils n'affectent pas l'état d'équilibre.
D'un autre côté, l'ajout d'une substance inerte en tant que gaz qui ne réagit avec aucun des réactifs ou des produits n'affectera pas la réaction directe ou directe, il aura donc un effet sur l'équilibre.
Application du principe de Le Châtelier
Comprendre ce principe est très utile, car il nous permet de manipuler l'état de l'équilibre d'une réaction à notre commodité.
Dans les cas dans lesquels nous sommes intéressés.
Ça signifie:
- Ajoutez de grandes quantités de réactifs, si ce sont économiques.
- Retirer le produit au fur et à mesure que la réaction progresse, afin de maintenir le système à l'état de tension constant, essayant toujours d'atteindre l'équilibre réagissant directement.
- Augmenter la température dans le cas des réactions endothermiques.
- Augmenter la pression sur les réactions dans lesquelles plus de molécules de gaz sont consommées qu'elles ne se produisent.
Nous pouvons également vouloir minimiser la quantité d'un produit formé par une réaction indésirable. Dans ces cas, nous faisons le contraire.
Exemple d'application du principe du châtelier
Dans la synthèse organique, le principe du châtelier est constamment utilisé pour améliorer les rendements des réactions.
Par exemple, dans les réactions de déshydratation d'alcool, des dessiccants sont ajoutés à l'environnement qui absorbe l'eau formée pendant la réaction. Cela réduit la concentration dudit produit, qui déplace l'équilibre vers les produits.

