Précipitations chimiques

- 3339
- 461
- Paul Dumas
 Réservoir de sédimentation pour le traitement de l'eau
Réservoir de sédimentation pour le traitement de l'eau Qu'est-ce que les précipitations chimiques?
La Précipitations chimiques Il s'agit d'un processus de traitement des eaux usées dans lequel des substances chimiques sont ajoutées pour transformer les ions polluants dissous en particules solides. En d'autres termes, il consiste à générer des particules sédimentables dans les eaux usées par l'ajout de produits chimiques.
L'objectif principal de la pluie chimique.
Bien que la plupart des polluants qui ont cherché à éliminer sont des métaux tels que le cobalt, le césium ou le mercure qui forment des cations (ions à charge positive), il est également utilisé pour éliminer les anions (ions avec une charge négative) tels que le fluorure, le cyanure et le phosphate.
Une fois que les solides ont précipité, il est nécessaire d'effectuer une série d'étapes pour pouvoir la séparer du reste de l'eau. Ces étapes incluent la floculation, la sédimentation et la séparation solide-liquide.
L'équilibre de la solubilité et des précipitations chimiques
La technique des précipitations chimiques est basée sur l'équilibre de la solubilité des composés ioniques et la constante du produit de solubilité. Dans la plupart des cas, les solides qui précipitent sont peu d'hydroxydes solubles, bien que d'autres types d'ions soient également précipités.
Dans tous les cas de précipitations chimiques, le solide qui est formé est un petit composé ionique soluble qui est en équilibre avec les ions en solution selon la réaction générale:
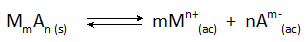
La concentration finale du métal, m, qui reste dans la solution est déterminée par la constante d'équilibre de cette réaction, ainsi que par la concentration de l'anion, a, qui est ajouté.
Par exemple, S'il s'agit d'un hydroxyde, la concentration finale du métal dépendra de la concentration d'ions hydroxyde dans la solution et, par conséquent, du pH.
Processus de précipitation chimique étape par étape
Le processus de précipitation chimique se compose de quatre étapes de base:
Étape 1: Ajout de l'agent précipitant et réglage du pH.
Il s'agit de l'étape initiale dans laquelle l'agent précipitant qui a été sélectionné est ajouté (dans la plupart des cas, c'est de l'hydroxyde de calcium). Le pH s'adapte pour maximiser les précipitations et optimiser la pureté finale de l'eau.
Peut vous servir: acrilonitrilo: structure, propriétés, production, utilisationsAu cours de cette étape, le mélange est normalement battu ou agité pour assurer une concentration précipitante uniforme.
Étape 2: Floculation.
Cette étape consiste à permettre aux petits solides qui se forment dans la première étape des précipitations de se réunir en formant des particules ou des "flocs" (d'où leur nom).
Celles-ci se sédimentont plus rapidement à l'étape suivante. Pour favoriser la formation de ces particules sans les casser, l'agitation devient plus lentement.
Étape 3: sédimentation.
Il consiste à laisser le mélange d'eau nouvellement traité se tenir dans un réservoir pour laisser toutes les particules solides aller à l'arrière-plan (sédimentation).
Étape 4: séparation solide-liquide.
Dans la plupart des cas, la séparation solide-liquide se compose d'une simple décantation de l'eau qui reste les sédiments. Dans d'autres cas, la séparation est réalisée en filtrant ou même à l'eau traitée, en fonction de la danger pour les polluants dangereux.
Types de précipitations chimiques
Précipitations d'hydroxyde
Il s'agit du type de précipitation chimique le plus courant et consiste à augmenter le pH en ajoutant un composé alcalin qui est presque toujours un hydroxyde de calcium (CA (OH)2).
La réaction chimique qui se produit est:

Dans la réaction précédente, M représente tout cation du métal qui est souhaité pour éliminer. Le solide formé dans ce cas est un très petit hydroxyde soluble.
Dans le cas des précipitations d'hydroxyde, la règle générale est que plus la concentration OH est grande- (Plus le pH) est élevé, plus la concentration du métal qui reste dans l'eau, après traitement. En d'autres termes, à un pH plus élevé, une plus grande pureté finale de l'eau.
Précipitations avec des sulfures
Ce type de précipitation chimique est principalement utilisé pour l'élimination des métaux lourds, comme le plomb ou le mercure, sous la forme de très peu de sulfures solubles. Pour y parvenir, il peut être ajouté à l'eau pour traiter à la fois des sulfures solubles et insolubles.
Les sulfures les plus couramment utilisés sont des solubles qui incluent le sulfure d'hydrogène (H2S) et sulfure de sodium (na2S). La réaction générale des précipitations est:
Peut vous servir: alliage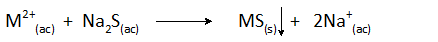
Un sulfure ferreux peut également être ajouté qui est insoluble, mais fournit suffisamment d'ions sulfure à la solution pour précipiter la majorité des métaux lourds.
Précipitations de carbonate
Les carbonates de nombreux métaux sont même moins solubles que les hydroxydes et peuvent précipiter des eaux usées en ajoutant du carbonate de calcium ou en faisant tourner des hydroxydes de dioxyde de carbone dans le mélange alcalisé dans le mélange alcalisé.
Précipitation du cyanure
Contrairement aux cas précédents, nous cherchons ici à précipiter le cyanure, qui est un anion, au lieu d'un métal. Le cyanure est un contaminant toxique très dangereux et peut être retiré des eaux usées en ajoutant du sulfate de zinc ou du sulfate ferreux, car il forme complexe avec ces métaux qui précipitent.
Coprécipitation
La coprécipitation se produit lorsqu'un soluté précipite avec un autre. Dans ces cas, le premier soluté est pris dans le solide lorsqu'un précipité d'un autre composé est formé.
C'est comme si le solide lors de la formation laissait le premier soluté et le traîne hors de la solution. Ce phénomène est utilisé pour éliminer certains polluants difficiles à précipiter.
Applications
Les précipitations chimiques sont utilisées dans les industries sans fin afin de répondre aux exigences environnementales de la qualité des eaux usées.
Précipitations d'hydroxyde Il est utilisé dans les industries de:
- Finitions métalliques
- Fabrication de composés inorganiques
- Fondements
- Fabrication de feux d'artifice et d'explosifs
- Émail en porcelaine
- Mine de charbon
- L'industrie pharmaceutique, entre autres.
D'un autre côté, Précipitations avec des sulfures Il est utilisé dans l'industrie pour éliminer les contaminants tels que le mercure, le plomb et l'argent. Cela a une demande dans les industries suivantes:
- Industrie du textile
- Exploitation minière
- Équipement et fournitures photographiques
- Fabrication de métaux non ferreux, entre autres
En plus de ces industries, les précipitations sont la technique la plus importante pour Purification de l'eau de refroidissement des réacteurs nucléaires. Dans cette industrie, il est utilisé pour éliminer les cations radioactives telles que le plutonium, l'ammérico, le Cesio et d'autres.
Exemples de précipitations chimiques
Précipitation du strontium avec carbonate de calcium
La réaction de précipitation dans ce cas est:
Peut vous servir: oxydes d'azote (NOx)
La réaction est effectuée à un pH optimal de 10,5 et atteint des concentrations de ce métal jusqu'à 100 fois plus bas que l'initiale.
Précipitations d'hydroxyde d'antimoine
Pour éliminer l'antimoine des eaux usées, l'hydroxyde de titane peut être utilisé comme réactif précipitant. La réaction est:

Ceci est effectué dans une plage de pH qui passe de 5 à 8,5 et réduit également la concentration à une valeur 100 fois moins que l'initiale.
Précipitation au césium avec du tétrapénylborate
Il s'agit d'un cas spécial qui permet des précipitations au cezium, un métal alcalin difficile à précipiter. La réaction est:

L'utilisation du tétraphénylborarate apporte deux grands avantages: d'abord, qui fonctionne pratiquement à tout pH (de pH 1 à 13) et deuxièmement, que la solubilité à faible sel formé permet de réduire la concentration finale du contaminant par mille facteurs mille mille.
Précipitation en cuivre avec sulfure de sodium
La réaction de précipitation dans ce cas est:
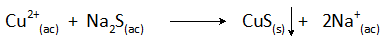
L'élimination du cuivre des eaux usées par cette méthode est effectuée à des valeurs de pH supérieures à 8 et sa concentration est réduite de plus de 99%.
Coprécipitation du chrome, du plomb et du zinc avec l'hydroxyde ferrique et l'hydroxyde d'aluminium
Dans ce cas, un hydroxyde de sodium est ajouté à l'eau pour précipiter le fer et l'aluminium qui est présent sous forme d'hydroxyde ferrique (Faith (OH)3) et l'hydroxyde d'aluminium (AL (OH)3). Lorsque ces deux hydroxydes précipitent, ils traînent une partie des ions chrome, plomb et zinc. Le traitement postérieur avec du sulfure d'hydrogène élimine presque tous ces trois métaux.
Les références
- Wang, L. K., Vaccari, D. POUR., Li, et., & Shammas, n. K. (2005). Précipitations chimiques. Processus de traitement physique, 141-197. Doi: 10.1385 / 1-59259-820-X: 141
- Striebig, b.POUR. (2005). Précipitations chimiques. Dans Water Encyclopedia (eds. J.H. Lehr et J. Keeley). https: // doi.org / 10.1002 / 047147844X.PC101
- Britannica, t. Rédacteurs en chef d'Encyclopaedia (2018, 8 février). Précipitations chimiques. Encyclopédie Britannica. https: // www.Britannica.Com / Science / Procipitation chimique
- D. Bhattacharyya, un. B. Jumawan Jr. & R. B. Grieves (1979) Séparation des métaux lourds toxiques par la précision de sulfure, la science et la technologie de la séparation, 14: 5, 441-452, doi: 10.1080/01496397908058096
- Marina Maya Marcioretto, Harry Bruning et Wim Rulkens (2005) Hourde Metals Precision in Sewage Sludge, Séparation Science and Technology, 40:16, 3393-3405, doi: 10: 10.1080/01496390500423748

