Ritchter-wenzel Law ce qui est, histoires, déclarations, exemples
- 3326
- 665
- Mlle Ambre Dumont
La Loi Ritchter-Wenzel ou des proportions réciproques est celle qui établit que les proportions de masse entre deux composés permettent de déterminer celle d'un troisième composé. C'est l'une des lois de la stœchiométrie, ainsi que la loi de Lavoisier (loi de conservation de la masse); la loi Proust (loi des proportions définies); et la loi de Dalton (loi de proportions multiples).
Ritcher a énoncé sa loi en 1792 dans un livre qui a défini les fondations de la stoechiométrie, basée sur les travaux de recherche de Carl F Wenzel, qui en 1777 a publié le premier tableau d'équivalence pour les acides et les bases.
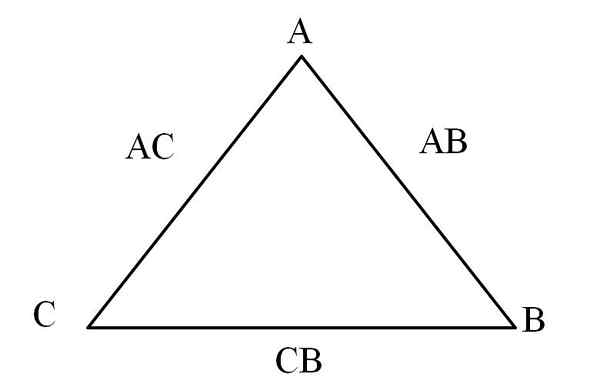
 Triangle de réciprocité. Source: Gabriel Bolívar
Triangle de réciprocité. Source: Gabriel Bolívar Un moyen simple de le visualiser est par un "triangle réciproque" (image supérieure). Si les masses de A, C et B sont connues qui sont mélangées pour former les composés AC et AB, il peut être déterminé combien de C et B sont mélangés ou réagis pour former le composé CB.
Dans les composés AC et AB, l'élément A est présent dans les deux, donc lors de la division de leurs proportions de masse, c'est la quantité que C réagit avec B.
[TOC]
Histoire et généralités de la loi des proportions réciproques
Richter a constaté que la proportion de poids des composés consommés dans une réaction chimique est toujours la même.
À cet égard, Ritcher a constaté que 615 parties sont nécessaires par le poids de la magnésie (MGO), par exemple, pour neutraliser 1000 parties en poids d'acide sulfurique.
Entre 1792 et 1794, Ritcher a publié un résumé de trois volumes qui contenaient son travail sur la loi des proportions définies. Le résumé a essayé la stoechiométrie, la définissant comme l'art des mesures chimiques.
Peut vous servir: chromatographie en couche fine: caractéristiques, à quoi sert-ellePointant, en outre, que la stœchiométrie traite des lois selon lesquelles des substances sont jointes pour former des composés. Cependant, les travaux de recherche de Richter ont été critiqués pour le traitement mathématique qu'il a utilisé, notant qu'il avait ajusté ses résultats.
En 1802, Ernst Gottfried Fischer a publié le premier tableau des équivalents chimiques, qui a utilisé l'acide sulfurique avec la figure de 1000; Similaire à la valeur trouvée par Richter, pour la neutralisation de l'acide sulfurique par la magnésie.
Cependant, il a été souligné que Richter a construit un tableau de pesos combinés indiquant la proportion dans laquelle un certain nombre de composés ont réagi. Par exemple, il est indiqué que 859 parties NaOH neutralisent 712 parties de HNO3.
Déclarations et conséquences
L'énoncé de la loi de Richter-Wenzel est le suivant: les masses de deux éléments différents qui sont combinés avec la même quantité d'un troisième élément, gardez la même relation que les masses de ces éléments lorsqu'elles sont combinées les unes avec les autres.
Cette loi a permis d'établir le poids équivalent, ou le gramme de rasage du poids, comme la quantité d'un élément ou d'un composé qui réagira avec une quantité fixe d'une substance de référence.
Richter a appelé les poids combinés liés aux poids des éléments combinés avec chaque gramme d'hydrogène. Les poids de combinaison relatifs de Richter correspondent à ce qui est actuellement connu comme un poids équivalent des éléments ou des composés.
Conformément à l'approche précédente, la loi de Richter-Wenzel peut être indiquée comme suit:
Les poids combinés de différents éléments qui sont combinés avec un certain poids d'un élément donné sont les poids de combinaison relative de ces éléments lorsqu'ils sont combinés les uns avec les autres, ou des multiples ou des sous-titres de ces relations de quantités.
Il peut vous servir: méthodes de séparation des mélanges hétérogènesExemples
Chlorure de calcium
Dans l'oxyde de calcium (CAO), 40 g de calcium sont combinés avec 16 g d'oxygène (O). Pendant ce temps, dans l'oxyde hypochlouleux (Cl2O), 71 g de chlore sont combinés avec 16 g d'oxygène. Quel composé se formerait le calcium s'il était combiné avec du chlore?
En utilisant le triangle de réciprocité, l'oxygène est l'élément commun pour les deux composés. Les proportions de masse des deux composés oxygénés sont déterminées en premier:
40G CA / 16 GO = 5G CA / 2G ou
71G CL / 16G ou
Et maintenant diviser les deux proportions de masse de Cao et Cl2Ou nous aurons:
(5G CA / 2G O) / (71G CL / 16G O) = 80G CA / 142G CL = 40G CA / 71G CL
Notez que la loi des proportions en masse est remplie: 40 g de calcium réagissent avec 71 g de chlore.
Oxydes de soufre
L'oxygène et le soufre réagissent avec le cuivre pour donner du cuivre (Cuo) et du sulfure de cuivre (CUS), respectivement. Combien de soufre réagirait avec l'oxygène?
Dans l'oxyde de cuivre, 63,5 g de cuivre sont combinés avec 16 g d'oxygène. En sulfure de cuivre, 63,5 g de cuivre sont rejoints à 32 g de soufre. Diviser les proportions de masse que nous avons:
(63,5 g Cu / 16g o) / (63,5 g Cu / 32g s) = 2032g s / 1016g o = 2g s / 1g ou
La proportion de masse 2: 1 est un multiple de 4 (63,5 / 16), ce qui montre que la loi de Richter est remplie. Avec cette proportion, le monoxyde de soufre SO (32 g de soufre réagit avec 16 g d'oxygène) est obtenu.
Si cette proportion est divisée par deux, il y aura 1: 1. Encore une fois, il est maintenant 4 ou 2, et c'est donc le SO2, Dioxyde de soufre (32 g de soufre réagit avec 32 g d'oxygène).
Peut vous servir: Fucosa: caractéristiques, structure, fonctionsSulfure et oxyde de fer
Le sulfure de fer (FES) est réagi, dans lequel 32 g de soufre sont combinés avec 56 g de fer, avec un oxyde ferreux (laid), dans lequel 16 g d'oxygène sont combinés avec 56 g de fer. Cet élément sert de référence.
Dans les composés de réaction FES et laids, le (s) et l'oxygène (O) en relation avec le fer (foi) se trouvent dans la proportion 2: 1. Dans l'oxyde sulfureux (donc), 32 g de soufre sont combinés avec 16 g d'oxygène, donc le soufre et l'oxygène se trouvent dans la proportion 2: 1.
Cela indique que la loi des proportions réciproques ou de la loi de Richter est accomplie.
La proportion trouvée entre le soufre et l'oxygène dans l'oxyde de soufre (2: 1), pourrait être utilisée, par exemple, pour calculer la quantité d'oxygène réagit avec 15 g de soufre.
o Oxygène g = (15g de s) ∙ (1g d'O / 2g de S) = 7,5 g
Les références
- Loi de la proportion réciproque: définition et exemple. Étude. Récupéré de: étudier.com
- Loi des proportions réciproques. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org

