Forces de van der Waals
- 4506
- 49
- Adam Mercier
Nous expliquons ce que sont les forces, leurs caractéristiques, types et donnent des exemples dans chacun
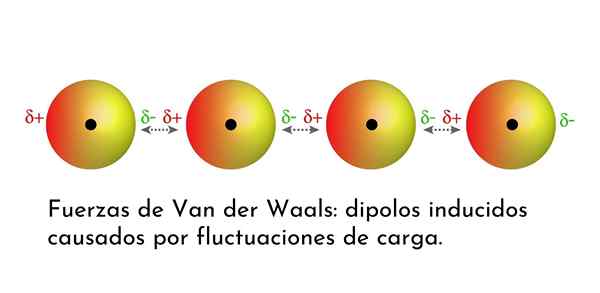
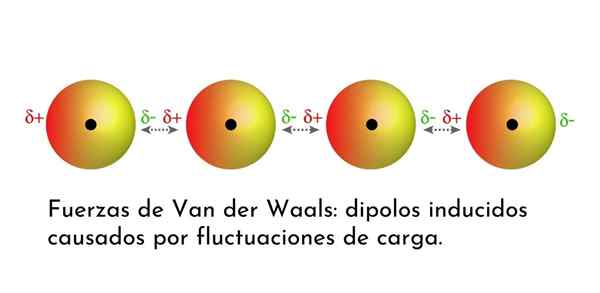 Illustration qui montre l'un des types de forces de van der Waals, les forces de dispersion de Londres, parmi plusieurs atomes avec dipôle instantané
Illustration qui montre l'un des types de forces de van der Waals, les forces de dispersion de Londres, parmi plusieurs atomes avec dipôle instantané Quelles sont les forces de van der Waals?
Le Forces de van der Waals Ils sont un ensemble de forces d'attraction à courte répartition entre tous les atomes et les molécules. Ils reçoivent leur nom en l'honneur du scientifique néerlandais Johannes Diderik van der Waals.
Ces forces sont relativement faibles, mais apparaissent sur toute la surface de contact entre deux atomes, entre deux molécules ou entre deux surfaces, donc, si cette surface de contact est grande, les forces de van der Waals peuvent devenir considérables.
La compréhension des forces de Van der Waals permet de prédire qualitativement de nombreuses propriétés physiques des substances chimiques, telles que leurs points de fusion et d'ébullition et de solubilité dans différents types de solvants. Ce sont les forces qui permettent d'expliquer comment il est possible qu'un gaz monoatomique comme l'hélium, qui ne forme aucun type de liaison chimique, puisse se condenser et se déplacer vers l'état liquide.
Ces forces expliquent également pourquoi une substance comme l'eau, qui est formée par des molécules dont la masse molaire n'est que 18 g / mol, est liquide, tandis que le chlore, qui pèse presque 4 fois plus, est un gaz à température ambiante.
Caractéristiques des forces de van der Waals
En plus de représenter un type de force d'attraction entre les atomes et les molécules, les forces de van der Waals ne partagent pas beaucoup de caractéristiques avec les liaisons chimiques. Ensuite, les caractéristiques les plus remarquables de ce type de forces sont présentées:
- Ce sont des forces qui dépendent de la distance. Dans le cas le plus simple, ils diminuent avec le carré de la distance. De plus, ils dépendent fortement de la géométrie moléculaire.
- Par rapport aux forces d'attraction qui se produisent dans les liens ioniques, covalents et métalliques, les forces de van der Waals sont relativement faibles.
- À l'exception des interactions dipol-dipolo, ce sont des interactions de température indépendantes.
- Ce sont des forces de rangement courtes, ce qui signifie qu'ils diminuent rapidement à mesure que les atomes et les molécules s'éloignent.
- Ce sont des forces générales qui se produisent entre tout atome et toute molécule.
- Contrairement aux liaisons covalentes, ils n'ont pas de directionnalité. Cela signifie que, quelle que soit l'orientation avec laquelle deux molécules s'approchent, si elles s'approchent suffisamment, les forces de van der Waals apparaîtront toujours.
- Lorsque deux molécules ou atomes s'approchent trop, la force devient répulsive, ce qui empêche les molécules de s'effondrer mutuellement.
- Ils sont additifs, ce qui signifie que, bien qu'ils soient considérablement faibles, l'existence de nombreuses interactions simultanées peut rendre la force d'attraction totale.
Types de forces de van der Waals
En plus de la composante répulsive qui garantit que les atomes et les molécules ne s'effondrent pas, il existe trois types de forces van der Waals, qui peuvent ou non agir en même temps entre deux molécules ou atomes. Ceux-ci sont présentés ci-dessous:
1. Interactions dipolo-dipolo ou forces de keesom
La force de Keesom est l'un des contribuables à la force de van der Waals. Ce sont les forces d'interaction électrostatique qui apparaissent parmi les dipôles permanents des molécules polaires telles que l'eau, l'acétone et autres.
Les forces de Keesom sont similaires aux forces électrostatiques entre les ions, mais diffèrent de celles-ci en ce qu'elles sont beaucoup plus faibles et se décomposent avec la sixième puissance de la distance (c'est-à-dire avec R6). La raison pour laquelle ils sont plus faibles est que l'attraction se produit entre les charges partielles d'un dipôle, au lieu de charges électriques entières comme dans le cas des ions.
Ces interactions ne sont données que entre les molécules et non entre les atomes, car les atomes n'ont pas de moments dipolaires permanents. De plus, la force de Keesom est inversement proportionnelle à la température, ce qui signifie que, lorsqu'il augmente, la force de Keesom diminue.
Exemples de molécules qui ont des interactions dipol-dipolo
Toutes les molécules polaires ont des interactions dipol-dipole entre elles. Par exemple:
- Deux molécules d'acétone.
- Deux molécules de chloroforme.
- Une molécule de cyclohexanone avec une molécule d'acétone.
2. Interactions dipolo-dipolo induites ou forces Debye
Lorsqu'une molécule polaire s'approche d'un atome ou d'une molécule apolaire, le dipôle du premier attire ou répète les électrons à la surface de la seconde. Cela induit un dipôle dans la molécule apolaire, qui est appelé dipôle induit. Le nouveau dipôle formé, puis interagit avec le dipôle d'origine créant une petite force d'attraction.
Peut vous servir: chaleur de combustionCes interactions entre un dipôle permanent et induit sont généralement connues sous le nom de forces Debye, et dépendent non seulement de la distance entre les deux molécules ou entre la molécule polaire et un atome individuel, mais dépendent également de la polarisabilité de la molécule apolaire et de l'ampleur du moment dipolaire de la molécule polaire.
Exemples de molécules qui ont induit des interactions dipolaires-dipole
Ce type d'interactions n'est donné que entre différentes molécules, car l'une est nécessaire pour être polaire et que l'autre ne fait pas. Certains exemples sont:
- Un atome d'un gaz noble comme l'argon et un composé polaire comme le chlorure d'hydrogène. Dans ce cas, la charge partielle positive dans l'hydrogène HCL attire les électrons de valence de l'argon, générant un petit dipol induit dans ce dernier. Si un argon s'approche de l'atome de chlore, la charge partielle négative repoussera les électrons de valence et un dipôle induit est également formé.
- Le bromination moléculaire (Br2) Il est considérablement soluble dans l'eau, bien qu'il s'agisse d'un composé apolaire et de l'eau d'un solvant fortement polaire. L'explication est due, en partie, à la forte polarisabilité du brome qui vous permet de former des interactions considérablement fortes.
3. Induit des interactions induites par Dipolo-dipolo ou des forces de dispersion de Londres
De toutes les forces de van der Waals, les plus faibles sont les forces de dispersion de Londres. Ces interactions sont données entre tous les atomes et molécules en raison de l'apparition de dipôles instantanés dans n'importe quelle partie de leur structure.
Un dipôle instantané est un petit dipôle formé par une distribution asymétrique d'électrons de valence à un moment donné.
Peut vous servir: hydrocarbures insaturésComment les dipôles instantanés sont-ils générés?
Comme les électrons tournent autour du noyau, il peut arriver qu'à un moment il y ait plus d'électrons d'un côté que de l'autre, qui donne naissance à un dipôle. Ce petit dipôle disparaît rapidement alors que les électrons continuent de se déplacer dans le noyau, et c'est pourquoi ils sont appelés instantanés.
Des dipôles instantanés peuvent survenir n'importe où dans la structure d'une molécule et à tout moment, il peut y en avoir beaucoup. Les forces de dispersion de Londres sont constituées de l'interaction entre ces temps instantanés dans une molécule et ceux d'un autre.
Exemples de composés qui ont des forces de dispersion de Londres
Comme mentionné, ces types d'interactions se produisent entre tous les atomes et les molécules. Cependant, c'est dans les grandes molécules apolaires où son effet peut être mieux observé, car dans ces cas, c'est le seul type d'interaction intermoléculaire qui se produit.
Un exemple typique dans lequel ces forces sont très intenses est dans le cas des hydrocarbures aliphatiques à longue chaîne, en particulier dans les polymères tels que le polyéthylène.

