Fluorure de potassium (KF)
- 3722
- 657
- Prof Noah Collet
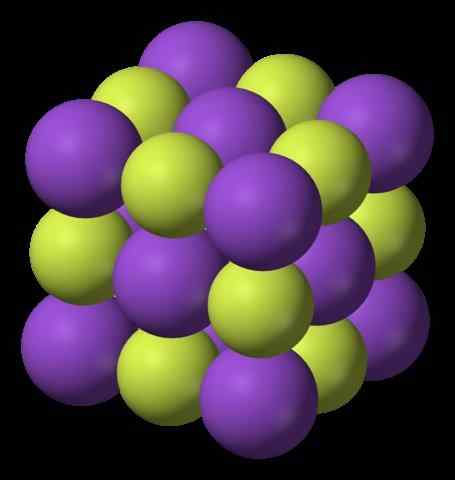
 Structure du fluorure de potassium. Source: Benjah-Bmm27, Wikimedia Commons
Structure du fluorure de potassium. Source: Benjah-Bmm27, Wikimedia Commons Qu'est-ce que le fluorure de potassium?Il Fluorure de potassium C'est un halogogénide inorganique qui se compose d'un sel formé entre le métal et l'halogène. Sa formule chimique est KF, ce qui signifie que pour chaque cation k+ Il y a un F- de homologue. Les interactions sont électrostatiques et, par conséquent, il n'y a pas de liens covalents K-F.
Ce sel est caractérisé par sa solubilité extrême dans l'eau, donc elle forme des hydrates, absorbe l'humidité et est délicieux. Par conséquent, il est très facile de préparer des solutions aqueuses, qui servent de source d'anions fluorures pour toutes ces synthèses où il est souhaité l'incorporer dans une certaine structure.
Le Ki est produit en réagissant du carbonate de potassium avec de l'acide fluorhorhorique, produisant du bifluoride de potassium (KHF2), qui, en raison de la décomposition thermique, finit par provoquer un fluorure de potassium.
Structure du fluorure de potassium
L'image supérieure montre la structure du fluorure de potassium. Les sphères violettes représentent les cations k+, Tandis que les sphères jaunâtres représentent les anions f-.
Notez que la disposition est cubique et correspond à une structure de sel Gema, très similaire à celle du chlorure de sodium. Toutes les sphères sont entourées de six voisins, qui constituent un octaèdre KF6 ou fk6, c'est-à-dire chaque k+ Il est entouré de six F-, Et il en va de même pour vice versa.
Il a été mentionné précédemment que le KF est hygroscopique et, par conséquent, absorbe l'humidité de l'environnement. Ainsi, la disposition indiquée correspondrait à la forme anhydre (sans eau) et non à ses hydrates, qui absorbent autant d'eau que même solubiliser et "fondre" (délices).
Peut vous servir: néon: historique, propriétés, structure, risques, utilisationsHydrater
Les structures cristallines des hydrates deviennent moins simples. Parce que maintenant les molécules d'eau interviennent directement dans les arrangements et interagissent avec les ions k+ et f-. L'un des hydrates les plus stables est le kf · 2H2O Y KF · 4H2SOIT.
Dans les deux hydrates, les octaèdres nouvellement mentionnés sont déformés en raison des molécules d'eau. Cela est principalement dû aux ponts d'hydrogène entre F- et le h₂o (f--Hoh). Des études cristallographiques ont déterminé que, malgré cela, les deux ions continuent de maintenir le même nombre de voisins.
En conséquence, la structure cubique d'origine pour le fluor de potassium anhydre.
Les anhydros partagent le plus délicat.
Propriétés du fluorure de potassium
- Poids moléculaire: 58 097 g / mol.
- Apparence physique (couleur): Cristaux cubiques blancs ou poussière cristalline délicate.
- Saveur: saveur de solution saline aiguë.
- Point d'ébullition: 2.741 ° F à 760 mmHg (1502 ° C). Dans un état liquide, il devient un chef d'orchestre d'électricité, bien que les anions f peuvent- Ne collaborez pas au même degré de conduite que k+.
- Point de fusion: 1.576 ° F; 858 ° C; 1131 K (KF Anhidro). Cela indique ses forts liens ioniques.
- Solubilité: Soluble en hf, mais insoluble dans l'alcool. Cela montre que les ponts d'hydrogène entre le fluor et les alcools, F--Hor, ils ne favorisent pas le processus de solvatation contre la dissolution de son réseau cristallin.
- Solubilité dans l'eau: anhydre 92 g / 100 ml (18 ° C); 102 g / 100 ml (25 ° C); Dihydrared 349.3 g / 100 ml (18 ° C). C'est-à-dire que le KF est hydraté, il devient plus soluble dans l'eau.
- Densité: 2,48 g / cm3.
- La pression de vapeur: 100 kPa (750 mm Hg) à 1.499 ° C.
- Décomposition: Lorsqu'il est chauffé en décomposition, il émet une fumée toxique de l'oxyde de potassium et du fluor à l'hydrogène.
- Action corrosive: Une solution aqueuse corrode le verre et la porcelaine.
- Point d'inflammation: Ce n'est pas une substance inflammable
- Indice de réfraction expérimental (ηd): 1.363.
- La stabilité: stable s'il est protégé de l'humidité, car sinon le solide est dissous. Incompatible avec des acides et des bases forts.
Utilisation du fluorure de potassium
- Ajuster le pH: Les solutions aqueuses de fluorure de potassium sont utilisées dans les applications et les processus industriels. Par exemple, les solutions KF permettent au pH d'être ajustée dans les fabricants qui sont effectués dans des installations de traitement textile et de lessive (elles approximativement une valeur de 7).
- Source de fluor: Le fluorure de potassium est, après le fluorure d'hydrogène, la principale source d'obtention de fluorure. Cet élément est utilisé dans les centrales nucléaires et dans la production de composés inorganiques et organiques, certains avec des utilisations telles que leur incorporation en dentifriques.
- Synthèse de la fluorocarbone: Le fluorure de potassium peut être utilisé dans la synthèse du fluorbone ou du fluorcarbure du chlorocarbone, en utilisant la réaction de Finkeistein. Dans cette réaction, l'éthylène glycol et le diméthylsulfoxyde sont utilisés comme solvants.
- Fluorination: Comme c'est une source de fluor où il se trouve dissous dans l'eau, à partir de leurs solutions, ils peuvent synthétiser des fluorures complexes, c'est-à-dire qu'ils sont incorporés avec F- aux structures. Un exemple est dans l'équation chimique suivante:
MNBR2(ac) + 3kf (ac) => kmnf3(S) + 2KBR (AC)
- Puis précipite le fluorure mixte de KMNF3. Ainsi, F pourrait être ajouté- faire partie d'un sel métallique complexe. En plus du manganèse, les fluorures d'autres métaux peuvent se précipiter: KCOF3, Kfef3, Manche3, KCF3 et kznf3.
- De même, le fluorure peut être incorporé de manière covalente dans un anneau aromatique, synthétisant l'organisation.
- Plusieurs: KF est utilisé comme matériel intermédiaire ou brut pour la synthèse de composés qui sont principalement utilisés dans l'agrochimie ou les produits de pesticide.
- De plus, il est utilisé comme agent fondateur de Weld.
Les références
- Fluorure de potassium. Récupéré de Chemicalbook.com.
- Fluorure de potassium. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.

