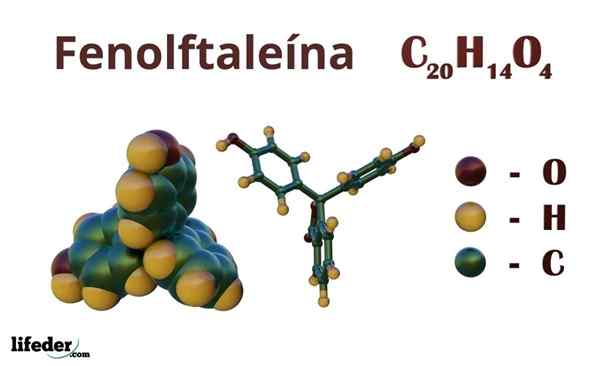
Phénolphthalein (C20H14O4)
- 2728
- 39
- Raphaël Charles
Qu'est-ce que Phenolphthalein?
La phénolphthaleine Il s'agit d'un colorant organique, qui est à son tour un acide diprotique faible, utilisé dans de nombreuses déterminations volumétriques comme indicateur acide-base. C'est-à-dire, s'il s'agit d'un acide diprotique, en solution, vous pouvez perdre deux ions H+, Et pour être un indicateur, vous devez avoir la propriété d'être coloré dans la gamme de pH qui est valorisée.
En milieu de base (pH> 8) La phénolphtaleine est rose, qui peut être intensifiée en rouge violet. Pour être utilisé comme indicateur acide-base, vous ne devez pas réagir plus rapidement avec OH- de l'environnement qui analyse pour déterminer.
De plus, comme il s'agit d'un acide très faible, la présence des groupes -COOH est exclue et, par conséquent, la source de protons acides est deux groupes OH liés à deux anneaux aromatiques.
Formule
La phénolphthaleine est un composé organique dont la formule chimique condensée est CvingtH14SOIT4. Bien que peut-être pas assez pour découvrir quels groupes organiques possèdent, à partir de la formule, vous pouvez calculer l'insaturation, afin de commencer à élucider votre squelette.
Structure chimique
 Structure de phénolphtaleine
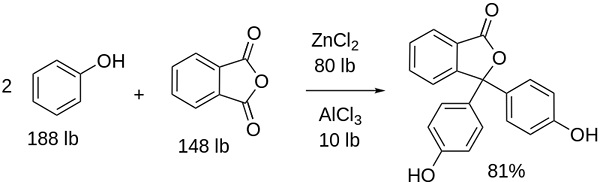
Structure de phénolphtaleine La structure de la phénolphthaleine est dynamique, ce qui signifie qu'elle subit des changements en fonction du pH de son environnement. Dans l'image supérieure, la structure de la phénolphtaleine dans la plage de 0 est illustrée C'est l'anneau pentagonal qui subit les plus grandes modifications. Par exemple, en milieu de base, lorsque l'un des groupes OH des anneaux phénoliques, leur charge négative (-o-) est attiré par l'anneau aromatique, "ouvrant" l'anneau pentagonal dans la nouvelle disposition de ses liens. Ici, la nouvelle charge négative est située dans le groupe -coo-, qui "est sorti" de l'anneau pentagonal. Ensuite, après avoir augmenté la basicité du milieu, le deuxième groupe OH des anneaux phénoliques et la charge qui en résulte est dévastatrice dans toute la structure moléculaire se dévore. L'image inférieure résume le résultat des deux non-déprotonations dans le milieu de base. Cette structure est responsable de la coloration rose familière de la phénolphtaleine. Les électrons qui «voyagent» à travers le système π conjugué (représenté avec les liaisons à double résonance) absorbent dans le spectre visible, spécifiquement à la longueur d'onde de la couleur jaune, reflétant la couleur rose qui atteint l'œil de l'attente. Phénolphthalein a au total quatre structures. Les deux précédents sont les plus importants en termes pratiques et sont représentés abrégés comme: H2Dans et dans et dans2-. La phénolphthaléine est utilisée dans l'analyse chimique comme indicateur visuel pour déterminer le point d'équivalence dans les réactions de neutralisation ou les degrés acides-base. Le réactif de ces évaluations acides est préparé à 1% dissous dans 90% d'alcool. Phénolphthalein présente 4 États: Ce comportement a permis l'utilisation de la phénolphtaleine comme indication de la carbonatation du béton, qui varie le pH à une valeur entre 8,5 et 9. De plus, le changement de coloration est très abrupte; c'est-à-dire, l'anion dans2- le rose est produit à grande vitesse. Par conséquent, cela vous permet d'être candidat comme indicateur dans de nombreuses déterminations volumétriques; Par exemple, celui d'un acide faible (acide acétique) ou fort (acide chlorhydrique). Phénolphthalein a été utilisé comme agent laxatif. Cependant, il existe une littérature scientifique indicative selon laquelle certains laxatifs qui contiennent de la phénolphtaléine comme principe actif - qui agit inhibant l'absorption de l'eau et des électrolytes dans le gros intestin favorisant les évacuations - pourrait avoir des effets négatifs. L'utilisation prolongée de ces médicaments contenant de la phénolphtaléine est associée à la production de plusieurs troubles du fonctionnement intestinal, de la pancréatite et même du cancer, produit principalement chez les femmes et dans les modèles animaux utilisés pour l'étude pharmacologique de ce composé chimique. La phénolphtaléine chimiquement modifiée, puis la transforme en son état réduit, est utilisée comme réactif dans les tests médico-légaux qui permettent de déterminer la présence d'hémoglobine dans un échantillon (test Kastle-Meyer), ce qui n'est pas concluant en raison de la présence de faux positifs. Il est formé par la condensation de l'anhydride phtalique avec le phénol, en présence d'acide sulfurique concentré, et un mélange d'aluminium et de chlorures de zinc comme catalyseurs de la réaction: La substitution électrophile aromatique est le mécanisme qui régit cette réaction. En quoi consiste? L'anneau phénolique (la molécule de la gauche) est chargé négativement grâce à l'atome d'oxygène riche en électrons, qui est capable de faire en sorte que toute paire gratuite voyage «le circuit électronique» de l'anneau. En revanche, le carbone du groupe C = O de l'anhydride phtalique. L'anneau phénolique, riche en électrons, attaque ce mauvais carbone dans les électrons, incorporant la première bague dans la structure. Cette attaque se produit préférentiellement à l'extrémité opposée du carbone lié au groupe OH; C'est la position -pour. Il en va de même pour le deuxième anneau: il attaque le même carbone et à partir de cela, une molécule d'eau générée est libérée grâce au milieu acide. De cette façon, la phénolphtaleine n'est rien de plus qu'une molécule d'anhydride phtalique qui a incorporé deux anneaux phénoliques dans l'un de ses groupes de carbonille (c = o). Son apparence physique est celle d'un solide blanc avec des cristaux tricliniques, souvent agglomérés ou sous forme d'aiguilles rhombiques. Il s'agit des toilettes, plus denses que de l'eau liquide (1 277 g / ml à 32 ºC) et très peu volatile (pression de vapeur estimée: 6,7 x 10-13 mmhg). Il est très peu soluble dans l'eau (400 mg / L), mais très soluble dans les alcools et l'éther. Pour cette raison, il est recommandé de le diluer dans l'éthanol avant d'être utilisé. Il est insoluble dans des solvants aromatiques tels que le benzène et le toluène, ou dans les hydrocarbures aliphatiques tels que le n-hexane. Trouvé à 262,5 ºC et le liquide a un point d'ébullition de 557,8 ± 50,0 ºC à la pression atmosphérique. Ces valeurs indiquent de fortes interactions intermoléculaires. Cela est dû aux ponts d'hydrogène, ainsi qu'aux interactions avant entre les anneaux. Son PKA est de 9,7 à 25 ºC. Cela se traduit par une tendance très basse à se dissocier en milieu aqueux: H2En (ac) + 2h2Ou (l) dans2-(AC) + 2H3SOIT+ Ceci est un équilibre aqueux. Cependant, l'augmentation des ions OH- Dans la solution, la quantité actuelle de H diminue3SOIT+. Par conséquent, l'équilibre se déplace vers la droite, pour produire plus de h3SOIT+. De cette façon, sa perte initiale est récompensée. Comme plus de base est ajoutée, l'équilibre continue de se déplacer vers la droite, et ainsi de suite jusqu'à ce qu'il n'y ait rien de l'espèce H2Dans. À ce stade, l'espèce en2- Rosado Color la solution. Enfin, la phénolphtaleine se décompose lors du chauffage, émettant un acre et de la fumée irritante.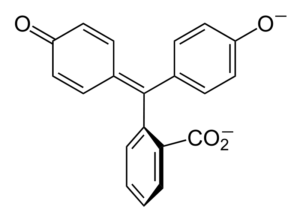
Utilisations / applications de phénolphtalein
 Ajout d'une solution alcaline à une solution neutre avec indicateur de phénolphtaléine
Ajout d'une solution alcaline à une solution neutre avec indicateur de phénolphtaléine Fonction d'indicateur
Utilisations en médecine
Synthèse de phénolphthaleine
Propriétés de la phénolphthaleine
Les références