Liaison covalente coordonnée
- 2730
- 168
- Lucas Schneider
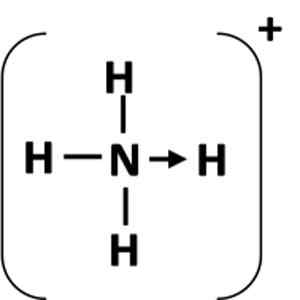
 Figure 1: Représentation d'un lien de coordination entre l'atome de donation (N) et l'accepteur (H).
Figure 1: Représentation d'un lien de coordination entre l'atome de donation (N) et l'accepteur (H). Qu'est-ce qu'un lien covalent coordonné?
UN liaison covalente coordonnée, ou le lien de coordination, estUn type de lien dans lequel l'un des atomes fournit tous les électrons partagés. Il est également appelé lien datif ou bipolaire.
Dans un simple lien covalent, chaque atome fournit un électron au lien. D'un autre côté, dans un lien de coordination, un seul atome donne les électrons pour former le lien, et est appelé l'atome de donation, tandis que l'atome qui accepte la paire d'électrons à rejoindre est appelé Accepteur Atom.
Un lien de coordination est représenté par une flèche qui commence à partir des atomes de don et se termine dans l'atome accepteur (figure 1). Dans certains cas, le donateur peut être une molécule.
Dans ce cas, un atome de la molécule peut donner la paire d'électrons, qui serait la base de Lewis, tandis que la molécule avec la capacité d'accepteur serait l'acide Lewis.
Un lien de coordination a des caractéristiques similaires à celles d'une simple liaison covalente. Les composés qui ont ce type de lien ont généralement un faible point de fusion et d'ébullition, avec une interaction coulombique non existante entre les atomes (contrairement à la liaison ionique) et les composés sont très solubles dans l'eau.
Quelques exemples de liens covalents coordonnés
L'exemple le plus courant d'un lien de coordination est l'ion ammonium, qui est formé par la combinaison d'une molécule d'ammoniac et d'un proton à partir d'un acide.
Peut vous servir: Équation chimique: pièces et exemplesDans l'ammoniac, l'atome d'azote a une paire d'électrons solitaire après avoir terminé son octet. Fait cette paire solitaire à l'ion hydrogène, donc l'atome d'azote devient un donneur. L'atome d'hydrogène devient l'accepteur.
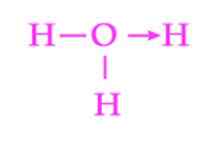 Figure 2: Représentation du lien de coordination de l'ion hydronio
Figure 2: Représentation du lien de coordination de l'ion hydronio Un autre exemple courant de lien datif est la formation de l'ion hydronium. Comme pour l'ion ammonium, la paire d'électrons libres de la molécule d'eau sert de donneur au proton qui est l'accepteur (figure 2).
Cependant, il faut garder à l'esprit qu'une fois le lien de coordination établi, tous les hydrogènes attachés à l'oxygène sont exactement équivalents. Lorsqu'un ion hydrogène se brise à nouveau, il n'y a pas de discrimination entre laquelle des hydrogènes est libérée.
Un excellent exemple de réaction d'acide à base d'acide, qui illustre la formation d'une liaison covalente coordonnée est la réaction de formation de l'adduit de trifluoride de bore avec l'ammoniac.
Le trifluorure de boro est un composé qui n'a pas de structure de gaz noble autour de l'atome de boro. Le boron n'a que 3 paires d'électrons dans sa couche de valence, il est donc dit que le BF3 est déficient en électrons.
Le couple d'azote d'azote de l'ammoniac peut être utilisé pour surmonter cette carence, et un composé est formé qui implique un lien de coordination.
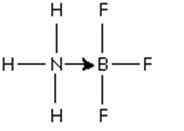 Figure 3: Adducteur entre la molécule de trifluorure de bore et l'ammoniac
Figure 3: Adducteur entre la molécule de trifluorure de bore et l'ammoniac Cette paire d'électrons azotés est donnée à l'orbital p vide de bore. Ici, l'ammoniac est la base de Lewis et BF3 est l'acide de Lewis.
Peut vous servir: valences azotésChimie de coordination
Il existe une branche de chimie inorganique dédiée exclusivement à l'étude des composés qui forment des métaux de transition. Ces métaux se lient à d'autres atomes ou molécules par des liaisons de coordination pour former des molécules complexes.
Ces molécules sont connues sous le nom de composés de coordination et la science qui les étudie est appelée coordination chimie.
Dans ce cas, la substance liée au métal, qui serait le donneur d'électrons, est connue sous le nom de ligature et communément des composés de coordination sont appelés complexes.
Les composés de coordination comprennent des substances telles que la vitamine B12, l'hémoglobine et la chlorophylle, les colorants et les pigments et les catalyseurs utilisés dans la préparation de substances organiques.
Un exemple d'ion complexe serait le complexe de cobalt [CO (NH2Ch2Ch2NH2) 2Clnh3]]2+ Ce serait le Dichloroaminethylandiamin Cobalt (IV).
La chimie de coordination est née des travaux d'Alfred Werner, un chimiste suisse qui a examiné divers composés de chlorure de cobalt (III) et Ammoniac. Après l'ajout d'acide chlorhydrique, Werner a observé que l'ammoniac ne pouvait pas être complètement éliminé. Il a ensuite proposé que l'ammoniac soit plus étroitement lié à l'ion de cobalt central.
Cependant, lorsque du nitrate en argent aqueux a été ajouté, l'un des produits formés était un chlorure d'argent solide. La quantité de chlorure d'argent formé était liée au nombre de molécules d'ammoniac liées au chlorure de cobalt (III).
Par exemple, lorsque du nitrate d'argent a été ajouté à COCL3 · 6nh3, Les trois chlorures sont devenus du chlorure d'argent.
Cependant, lorsque du nitrate d'argent a été ajouté à Cocl3 · 5nh3, Seulement 2 des 3 chlorures ont formé du chlorure d'argent. Quand c'était cocl3.4nh3 Avec du nitrate d'argent, l'un des trois chlorures précipités sous forme de chlorure d'argent.
Il peut vous servir: acide píchric: qu'est-ce que la structure, la synthèse, les propriétésLes observations résultantes ont suggéré la formation de composés complexes ou de coordination. Dans la sphère de coordination interne, qui est également appelée dans certains textes la première sphère, les ligands sont directement unis au métal central.
Dans la sphère de coordination externe, parfois appelée la deuxième sphère, d'autres ions sont attachés à l'ion complexe. Werner a reçu le prix Nobel en 1913 pour sa théorie de la coordination.
Cette théorie de la coordination fait que les métaux de transition ont deux types de Valencia: la première Valence, déterminée par le numéro d'oxydation du métal, et l'autre Valencia appelée numéro de coordination.
Le nombre d'oxydation indique combien de liaisons covalentes peuvent être formées dans le métal (exemple, le fer (II) produit laid) et le numéro de coordination indique combien de liens de coordination peuvent être formés dans le complexe (exemple, le fer avec le numéro de coordination 4 produit [FECL4]]- et [fecl4]]2-).
Dans le cas de Cobalt, il a la coordination numéro 6. C'est pourquoi dans les expériences de Werner, en ajoutant le nitrate d'argent, la quantité de chlorure d'argent qui a laissé un cobalt hexaco-oralé a toujours été obtenu.
Les liaisons de coordination de ce type de composé ont la caractéristique d'être colorée.
En fait, ils sont responsables de la coloration typique associée à un métal (fonte rouge, cobalt bleu, etc.) et sont importants pour les répétitions spectrophotométriques de l'absorption et des émissions atomiques.
Les références
- Une liaison chimique. Récupéré de Britannica.com.
- Coordonner la liaison covalente (s.F.). Récupéré de la chimie.Tutorvista.

