Électrodialyse comment fonctionne, les avantages, les inconvénients, les utilisations
- 1757
- 433
- Anaïs Julien
La Électrodialyse C'est le mouvement des ions à travers une membrane semi-perméable, entraînée par une différence de potentiel électrique. Les membranes utilisées en électrodialyse ont la propriété d'être des échangeurs d'ions contre des cations ou des anions.
Les membranes d'échange de cations ont des charges négatives: ils laissent passer les cations et repousser les anions. Pendant ce temps, les membranes d'échange anionique ont une charge positive: ils ont laissé les anions et repousser les cations.
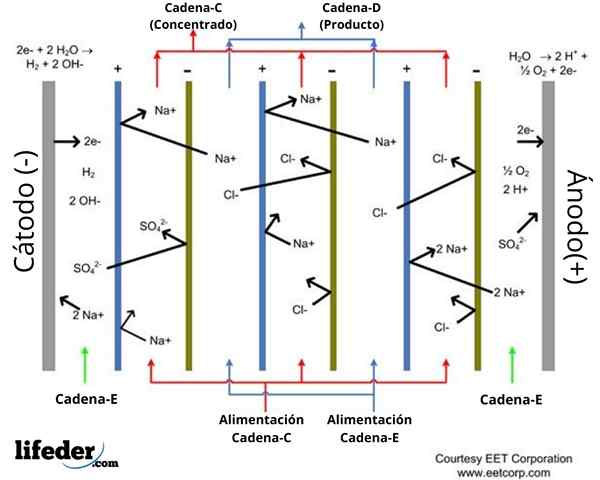
 Schéma d'un ensemble de cinq cellules électrodialysées. Source: CommonShelper2 via Wikipedia.
Schéma d'un ensemble de cinq cellules électrodialysées. Source: CommonShelper2 via Wikipedia. Les caméras ou cellules électrodialysées sont organisées en paquets avec plusieurs membranes d'anion et d'échange cationiques, qui alternent entre elles. Les membranes d'échange anioniques et cationiques délimitent les espaces où les processus de dilution et de concentration des liquides sont effectués.
La force motrice des flux ioniques qui traverse les membranes des cellules électrodialysées est une différence de potentiel électrique entre une cathode et une anode.
Entre-temps, dans l'osmose inverse, l'écoulement de l'eau du compartiment avec la plus grande osmolarité au compartiment d'osmolarité inférieur est dû à une augmentation de la pression hydrostatique, causée par l'action d'une pompe.
[TOC]
Comment fonctionne dans la dilution de l'eau?
Description d'un paquet de cinq cellules électrodialysées
Dans le schéma indiqué (image supérieure), l'emplacement de six membranes d'échange d'ions est indiqué: trois échanges de cations et trois échanges d'anions, qui sont entrecoupés les uns avec les autres. Ces membranes délimitent cinq compartiments où les liquides impliqués dans l'électrodialyse circulent (voir des flèches rouges et bleuâtre).
Les membranes d'échange anionique sont chargées positivement, apparaissant dans le schéma de couleur bleue. Ceux-ci permettent aux anions passer et repousser les cations pour la répulsion électrostatique.
Les membranes d'échange de cations, tandis, ont une charge négative, indiquant dans le schéma vert. Ils sont traversés par des cations, mais repousse les anions.
Il peut vous servir: Tester: caractéristiques, types, exemples d'utilisationsLes deux types de membranes sont étanches à l'eau. Le schéma montre deux espaces où se produit une dilution de la teneur en solution saline de l'eau. Dans le schéma, les flux aqueux d'entrée et de sortie de ces espaces sont indiqués en bleu, identifiés comme courant d.
Pendant ce temps, il y a trois espaces où l'eau circule avec une teneur élevée en solution saline, identifiée. Les flux de revenus et de sortie vers ces compartiments sont indiqués dans le régime en tant que C.
De même, les compartiments anode (+) et cathode (-) sont indiqués dans le schéma, à travers lequel le courant et.
Opération électrodialysée
Les cations sont attirées par la charge de la cathode (-), tout en repoussant l'anode (+). Les anions sont attirés par la charge de l'anode (+) et repoussés par la charge de la cathode (-).
L'observation, par exemple, des cellules trois, quatre et cinq, indique ce qui suit: Dans les cellules, trois et cinq circulent liquide concentré, tandis que dans la cellule, quatre circulats liquides circulent.
L'ion CL- du compartiment quatre est attiré par la charge de l'anode et traverse la membrane d'échange anionique qui la sépare du compartiment cinq.
Pendant ce temps, le na ion+ du compartiment cinq est repoussé par la charge positive de l'anode, mais incapable d'entrer dans le compartiment quatre. En effet.
D'un autre côté, le na+ du compartiment quatre est repoussé par l'anode (+) et traverse la membrane d'échange de cations (-) qui le sépare du compartiment trois.
En résumé: concentration en NA+ et cl- Quatre compartiments ont tendance à diminuer. Ensuite, la concentration de solution saline diminue les compartiments de dilution et l'augmentation des compartiments de concentration.
Il peut vous servir: chimie appliquée: objet d'étude, branches, importance, exemplesAvantages et inconvénients
avantage
-L'électrodialyse est un fonctionnement simple et continu.
-Le traitement chimique n'est pas nécessaire pour régénérer les membranes d'échange.
-Il y a un faible coût d'exploitation et de maintenance, nécessitant peu d'espace pour son fonctionnement.
Désavantages
-Des particules de diamètre supérieures à 1 µm peuvent entraver les membranes d'échange d'ions.
-Il n'est pas recommandé d'utiliser de l'eau avec une dureté supérieure à 1, car le carbonate de calcium crée une croûte dans les cellules de concentré.
-Nécessite un traitement d'élimination du dioxyde de carbone (CO2), car cela lorsque la dissociation peut modifier la conductivité de l'eau.
Différence entre dialyse et électrodialyse
La dialyse est le flux d'eau à travers une membrane semi-perméable du plus petit compartiment d'osmolarité vers le plus grand compartiment d'osmolarité. Le compartiment avec moins d'osmolarité a une plus grande concentration de molécules d'eau.
Pour cette raison, les flux d'eau, en faveur de son gradient de concentration, du compartiment avec moins d'osmolarité au compartiment avec une plus grande osmolarité.
L'électrodialyse, en revanche, est un flux d'ions à travers une membrane d'échange d'ions qui permet ou non des ions, selon sa charge électrique. La force motrice du mouvement des ions est une différence de potentiel électrique.
Contrairement à la dialyse, en électrodialyse, il n'y a pas de débit d'eau à travers les membranes et il n'y a qu'un flux d'ions.
Applications d'électrodialyse
Déminéralisation de l'eau
Il existe des usines d'électrodialyse qui traitent de l'eau avec des sels élevés pour produire de l'eau potable. L'électrodialyse est également utilisée pour traiter les eaux usées à partir d'un usage domestique et industriel, dans le but de les rendre adaptés à la consommation ultérieure.
Il peut vous servir: Erlenmeyer Flask: caractéristiques, utilisations, méthodes d'utilisationPlus précisément, l'électrodialyse est utilisée dans la récupération de métaux précieux présents dans les eaux effluentes des industries. Il est également utilisé dans l'élimination des sels et des solutions acides, et dans la séparation des composés ioniques des molécules neutres.
Industrie alimentaire
Bien que l'électrodialyse soit utilisée dans l'industrie pharmaceutique, dans les cosmétiques, ainsi que dans d'autres industries, son utilisation la plus répandue est dans l'industrie alimentaire. Parmi l'une de vos applications, nous pouvons mentionner ce qui suit:
-Sminéalisation du sérum et de la mélasse
-Stabilisation de l'acide tartrique du vin
-Diminution de l'acidité des jus de fruits
-Production de protéines végétales isolées
-Échec des protéines sériques
-Déminéralisation des huiles de soja et de poisson
-Élimination des ions alcalins de betterave et de la mélasse de canne
-Traitement des déchets de fruits de mer
-Déminéralisation du morsure du raisin et du jus de pomme de terre
-Concentration et récupération des acides organiques
-Production de protéines de soja
-Enrichissement antioxydant
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Wikipédia. (2020). Électrodialyse. Récupéré de: dans.Wikipédia.org
- Lentech b.V. (2020). Qu'est-ce que Edi? Récupéré de: lentech.com
- Mondor M., Ippersiel D., Lamarche F. (2012) Électrodialyse dans la transformation des aliments. Dans: Boye J., Arcand et. (EDS) Green Technologies in Food Production and Processing. Série de génie alimentaire. Springer, Boston, MA. est ce que je.org / 10.1007 / 978-1-4614-1587-9_12
- Akhter M, Habib G, Qamar His (2018) Application d'électrodiase dans le traitement des eaux usées et l'impact de l'encrassement sur les performances du processus. J Memb Sci Technol 8: 182. Doi: 10.4172 / 2155-9589.1000182
- H. Strathmann. (6 décembre 2006). L'électrodiase et son application dans l'industrie des processus chimiques. Taylor & Francis en ligne. est ce que je.org / 10.1080/03602548508068411
- « Caractéristiques et exemples de rédaction de troisième personne
- Les 8 exemples de ressources graphiques les plus pertinentes »

