Fingers de zinc, structure, classification, fonction
- 3103
- 799
- Lucas Schneider
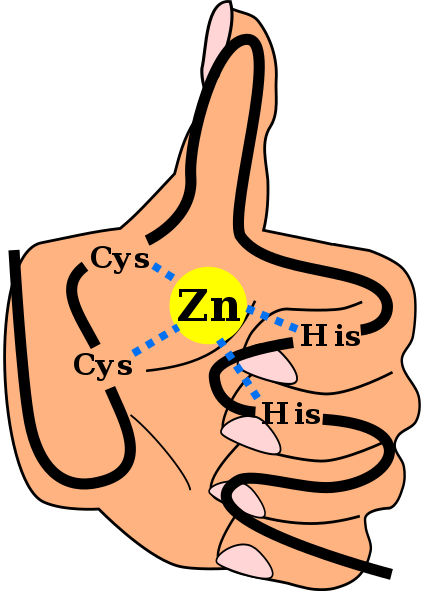
 Structure primaire d'un domaine du doigt de zinc C2H2, y compris les liens qui coordonnent l'ion zinc et avec un fond de "main et doigt". Angel Herraez, Wikimedia Commons
Structure primaire d'un domaine du doigt de zinc C2H2, y compris les liens qui coordonnent l'ion zinc et avec un fond de "main et doigt". Angel Herraez, Wikimedia Commons Les Doigts de zinc (ZF) sont des motifs structurels présents dans un grand nombre d'eucaryotes. Ils appartiennent au groupe de métalloprotéines, car ils sont capables d'unir l'ion métallique de zinc, dont ils ont besoin pour son opération. Il est prévu que plus de 1500 domaines ZF existent dans environ 1000 protéines différentes chez l'homme.
Le terme doigt de zinc ou «doigt de zinc» a été inventé pour la première fois en 1985 par Miller, McLachlan et Klug, tout en étudiant en détail les petits domaines de l'ADN de l'ADN du facteur transcriptionnel tfiiia de Xenopus Laevis, décrit par d'autres auteurs quelques années auparavant.
Les protéines avec les motifs ZF sont les plus abondantes dans le génome des organismes eucaryotes et participent à la diversité des processus cellulaires essentiels, parmi lesquels la transcription génétique, la traduction des protéines, le métabolisme, le pliage et l'assemblage d'autres protéines et lipides se distinguent, la mort cellulaire programmée, parmi les personnes parmi les cellules programmées, parmi la mort cellulaire programmée, parmi les parmi les cellules programmées, parmi les parmi les cellules programmées, parmi les parmi les cellules programmées, parmi les personnes, parmi la mort cellulaire programmée, parmi les parmi les cellules programmées, parmi les parmi les cellules programmées, parmi les personnes, parmi la mort cellulaire programmée, parmi les parmi les cellules programmées, parmi la mort cellulaire programmée, parmi les personnes, parmi la mort cellulaire programmée, parmi les parmi les cellules programmées. autres.
Structure
La structure des motifs ZF est extrêmement préservée. Habituellement, ces régions répétées ont 30 à 60 acides aminés, dont la structure secondaire est comme deux feuilles bêta antiparallèles qui forment une fourche et un proxy alpha, qui est indiqué comme ββα.
Cette structure secondaire est stabilisée par des interactions hydrophobes et par la coordination d'un atome de zinc donné par deux cystéine et deux déchets d'histidine (Cys2Son2). Cependant, il y a ZF qui peut coordonner plus d'un atome de zinc et d'autres où l'ordre de Cys et ses déchets varie.
Peut vous servir: acide palmitholéique: structure, fonctions, où est-ceZFS peut être répété en lot, configuré linéairement dans la même protéine. Tous ont des structures similaires, mais elles peuvent se différencier chimiquement par des variations de déchets clés d'acides aminés pour l'accomplissement de leurs fonctions.
Une caractéristique commune entre ZF est sa capacité à reconnaître les molécules d'ADN ou d'ARN de différentes longueurs, c'est pourquoi ils ont été initialement considérés comme des facteurs transcriptifs uniquement.
En général, la reconnaissance est de 3 pb les régions de l'ADN et est obtenue lorsque la protéine avec le domaine ZF présente l'hélice alpha à la rainure principale de la molécule d'ADN.
Classification
Il existe différentes raisons ZF qui diffèrent les unes des autres par leur nature et les différentes configurations d'espace qui réalisent les liens de coordination avec l'atome de zinc. L'une des classifications est la suivante:
C2H2
C'est une raison généralement trouvée dans le ZF. La plupart des raisons c2H2 Ils sont spécifiques à l'interaction avec l'ADN et l'ARN, cependant, ils ont été observés en participant aux interactions protéine-protéine. Ils ont entre 25 et 30 déchets d'acides aminés et se trouvent dans la plus grande famille de protéines régulatrices chez les mammifères.
C2H
Interagir avec l'ARN et certaines autres protéines. Ils sont principalement observés dans le cadre de certaines protéines de la capside de rétrovirus, collaborant dans l'emballage de l'ARN viral juste après la réplication.
C4 (boucle ou bande)
Les protéines avec ce motif sont des enzymes responsables de la réplication et de la transcription de l'ADN. Un bon exemple de ceux-ci peut être les enzymes brutes des phages T4 et T7.
C4 (Famille Gata)
Cette famille ZF comprend des facteurs de transcription qui régulent l'expression de gènes importants dans de nombreux tissus pendant le développement cellulaire. Les facteurs GATA-2 et 3, par exemple, sont impliqués dans l'hématopoïèse.
Il peut vous servir: ATP (Adénosine Triffosphate)C6
Ces domaines sont typiques des levures, en particulier la protéine Gal4, qui active la transcription des gènes impliqués dans l'utilisation du galactose et.
Doigts de zinc (c3HC4-C3H2C3)
Ces structures particulières ont 2 sous-types de domaine ZF (C3HC4 et C3H2C3) et sont présents dans de nombreuses protéines animales et végétales.
Ils se trouvent dans des protéines telles que RAD5, impliquées dans la réparation de l'ADN dans les organismes eucaryotes. Ils se trouvent également dans RAG1, indispensable pour la reconfiguration des immunoglobulines.
H2C2
Ce domaine ZF est fortement préservé dans les intégrales de rétrovirus et de rétrotransposon; Lorsque vous rejoignez des protéines blanches, cela provoque un changement conformationnel dans le même.
Les fonctions
Les protéines des domaines ZF servent à diverses fins: ils peuvent être trouvés dans les protéines ribosomales ou les adaptateurs transcriptifs. Ils ont également été détectés en tant que partie intégrante de la structure de l'ARN polymérase II de la levure.
Ils semblent être impliqués dans l'homéostasie intracellulaire du zinc et dans la régulation de l'apoptose ou de la mort cellulaire programmée. De plus, il existe certaines protéines ZF qui fonctionnent comme des chaperons pour le pliage ou le transport d'autres protéines.
L'union lipidique et un rôle fondamental dans les interactions protéine-protéine sont également des fonctions exceptionnelles des domaines ZF dans certaines protéines.
Importance biotechnologique
Au fil des ans, la compréhension structurelle et fonctionnelle des domaines ZF a permis de grandes avancées scientifiques qui impliquent l'utilisation de leurs caractéristiques à des fins biotechnologiques.
Étant donné que certaines protéines ZF ont une grande spécificité en raison de certains domaines d'ADN, beaucoup d'efforts sont actuellement investis dans la conception spécifique de la ZF, qui peut fournir des progrès précieux dans la thérapie génique chez l'homme.
Il peut vous servir: flore et faune de la Chine: espèces représentativesDes applications biotechnologiques intéressantes découlent également de la conception des protéines avec ZF modifié par le génie génétique. Selon l'extrémité souhaitée, certaines d'entre elles peuvent être modifiées par l'ajout de doigts avec des doigts "poli zinc", qui sont capables de reconnaître pratiquement toute séquence d'ADN avec une grande affinité et spécificité.
L'édition génomique avec des nucléas modifiées est l'une des applications les plus prometteuses aujourd'hui. Ce type d'édition offre la possibilité de mener des études sur la fonction génétique directement dans le système d'intérêt.
Le génie génétique utilisant des nucléasas ZF modifiés a attiré l'attention des scientifiques dans le domaine de l'amélioration génétique des cultivars d'importance agronomique. Ces nucléas ont été utilisés pour corriger un gène endogène qui produit des formes résistantes aux herbicides dans les plants de tabac.
Les nucléas avec ZF ont également été utilisés pour l'ajout de gènes dans les cellules de mammifères. Les protéines en question ont été utilisées pour générer un ensemble de cellules de souris isogéniques avec une série d'allèles définis pour un gène endogène.
Un tel processus a une application directe dans l'étiquetage et la création de nouvelles formes alléliques pour étudier la structure et les relations de fonction dans des conditions d'expression native et dans des environnements isogéniques.
Les références
- Berg, J. M. (1990). Domaines de doigts en zinc: hypothèses et connaissances actuelles. Examen annuel de la biophysique et de la chimie biophysique, 19(39), 405-421.
- Kluska, k., Adamczyk, J., & Krȩzel, un. (2017). Propriétés de liaison des métaux des doigts de zinc avec un site de liaison en métal naturellement alten. Métallomique, dix(2), 248-263.

