Concentration chimique

- 4848
- 39
- Adrien Remy
 La concentration chimique est ce qui détermine la proportion d'un soluté et un solvant dans une solution chimique
La concentration chimique est ce qui détermine la proportion d'un soluté et un solvant dans une solution chimique Qu'est-ce que la concentration chimique?
La Concentration chimique Il s'agit d'une propriété des solutions qui représente la quantité de soluté pour chaque unité de solution. En d'autres termes, c'est un nombre qui indique la proportion dans laquelle le soluté et le solvant sont situés.
Rappelons qu'une solution est un mélange homogène formé par un solvant (généralement liquide) et une ou plusieurs substances dissoutes dans le solvant que nous appelons des solutés. Les solutions sont caractérisées par le solvant, le soluté et la concentration.
La concentration est une propriété très utile, car elle nous permet de les décrire. Par exemple, si nous savons que la concentration de sel dans l'eau de mer est de 35 grammes pour chaque litre, alors nous savons que, dans notre maison, nous dissolvons 35 grammes de sel dans un litre de solution, nous obtiendrons une solution égale de salé que l'eau de mer.
Caractéristiques de la concentration chimique
C'est une propriété intensive
C'est la principale caractéristique de la concentration. Intensif signifie qu'il ne dépend pas de la quantité de solution que nous avons. Par exemple, cela signifie que la concentration est la même dans une goutte d'eau de mer que dans 100 litres.
Peut varier avec la température
En général, les liquides développent ou augmentent leur volume lors du chauffage. Cela est également vrai pour les solutions. Pour cette raison, les concentrations exprimées en fonction du volume peuvent changer légèrement lors du chauffage ou du refroidissement de la solution.
Il peut couvrir des gammes de plages très larges
Quelles que soient les unités dans lesquelles une concentration chimique est exprimée, elle peut avoir de valeurs relativement grandes à des valeurs extrêmement petites.
Par exemple, la concentration d'une solution exprimée en pourcentage peut avoir des valeurs de 0% à 100%, couvrant ainsi de nombreux ordres de grandeur. Nous pourrions préparer une solution à 90%, car nous pourrions également préparer un par 10-12%, qui est presque 14 ordres de grandeur mineure.
Quelle est la concentration chimique pour?
Connaître la concentration d'une solution nous permet de le décrire. Il existe de nombreuses propriétés de solutions qui dépendent de leur concentration. Par exemple, le point de fusion et d'ébullition dépend de la concentration, donc sachant qu'il nous permet de calculer ces deux propriétés.
Peut vous servir: État vitreuxD'un autre côté, la concentration nous permet de comparer facilement une solution avec un autre. Si nous avons deux solutions d'eau avec du sucre, la connaissance de leurs concentrations nous permettra de savoir laquelle des deux est plus douce.
De plus, toutes les réactions chimiques qui rendent la vie possible dépendent fortement de la concentration de solutés sans fin dans les cellules et de l'environnement des êtres vivants.
Par exemple, la concentration d'oxygène dans l'air détermine si une personne étouffera ou non; Le pH d'une solution (qui est un moyen de mesurer la concentration des ions H+) Déterminez si une bactérie vivra et se reproduira ou si, au contraire, elle mourra; et la concentration d'un poison déterminera si elle sera mortelle ou non.
Types d'unités de concentration
La concentration d'une solution en est une, il n'est donc pas correct de parler de types de concentration. Cependant, la même concentration peut être exprimée dans différents types d'unités de concentration. Ceux-ci sont:
- Unités de concentration physique
- Unités de concentration chimique
Unités de concentration physique
Ceux-ci se caractérisent par l'expression des quantités du soluté et du solvant en unités de masse ou de volume. Ils sont appelés unités physiques, car ils sont associés à des masses et des volumes au lieu de moles et équivalent.
Lorsque nous comparons deux solutions qui ont la même concentration physique, nous ne pouvons nous assurer qu'ils ont des quantités égales d'atomes et de molécules. C'est ce qui les distingue des unités de concentration chimique.
Les unités physiques de concentration les plus courantes sont:
- Titre simple (TS)
- % poids / poids (% p / p) ou masse / masse (% m / m)
- % poids / volume (% p / v) ou masse / volume (% m / v)
- % de volume / volume (% v / v)
- Pièces par million de poids / poids (PPMp / p) ou masse / masse (ppmm / m)
- Pièces par million de poids / volume (PPMP / V) ou masse / volume (ppmM / V)
- Pièces par million de volume / volume (PPMV / v)
Unités de concentration chimique
Dans le cas des unités chimiques, la quantité de soluté et, dans certains cas, celle du solvant ou de la solution, sont exprimées en termes de nombre de particules ou de moles ou d'équivalents présents dans la solution.
Ils sont appelés unités chimiques, car deux solutions qui ont la même concentration chimique ont des quantités équivalentes d'atomes, de molécules ou d'ions de soluté par unité de solution, car le cas peut être.
Peut vous servir: règles de solubilité: aspects et règles généralesLes unités chimiques les plus courantes sont:
- Molarité (M)
- MOLALITÉ (M)
- Fraction molaire (x)
- Normalité (n)
Formule des unités de concentration physique
Titre simple (TS)
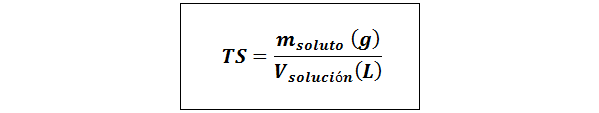
Où msoluté représente la masse du soluté en grammes et vsolution C'est le volume de la solution en litres.
% poids / poids (% p / p) ou masse / masse (% m / m)
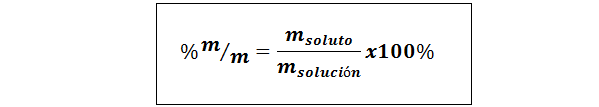
Où msoluté et Msolution représentent respectivement la masse du soluté et la solution. Toute unité de masse peut être utilisée (g, mg, kg, etc.), tant que les deux masses sont exprimées dans la même unité.
% poids / volume (% p / v) ou masse / volume (% m / v)
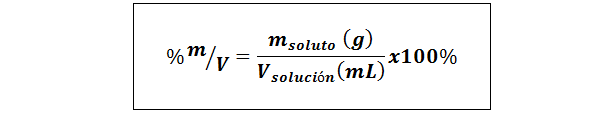
Où msoluté C'est la masse de la solution en grammes et vsolution C'est le volume de la solution, dans ce cas en millilitres.
% de volume / volume (% v / v)

Où Vsoluté et Vsolution représentent respectivement le volume du soluté et la solution. Dans ce cas, n'importe quelle unité peut être utilisée pour exprimer ces volumes, tant qu'elle est la même pour les deux.
Pièces par million de poids / poids (PPMp / p) ou masse / masse (ppmm / m)
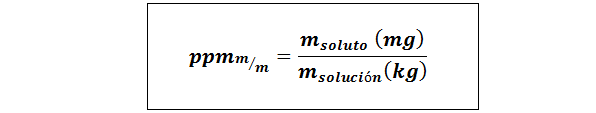
Où msoluté et Msolution Ils représentent la masse du soluté et la solution dans les milligrammes et les kilogrammes respectivement.
Pièces par million de poids / volume (PPMP / V) ou masse / volume (ppmM / V)
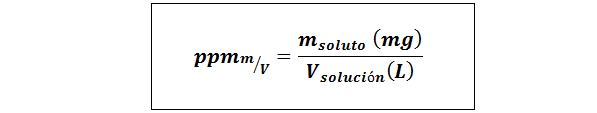
Où msoluté C'est la masse de la solution en milligrammes et Vsolution C'est le volume de la solution, dans ce cas en litres.
Pièces par million de volume / volume (PPMV / v)
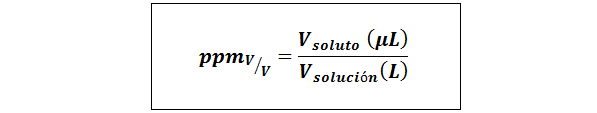
Où Vsoluté et Vsolution Ils sont le volume du soluté et la solution dans les microlitres et les litres, respectivement.
Formules des unités de concentration chimique
Dans le cas des unités de concentration chimique, la quantité de composants de la solution, en particulier du soluté, est exprimée soit en nombre de moles, soit en nombre d'équivalents. Ces quantités ont le nombre réel de particules (atomes, molécules ou ions, selon le cas).
Ces quantités ne peuvent pas être connues simplement en pesant ou en mesurant le volume de substances, mais il est nécessaire de connaître la composition ou la formule chimique des composés afin de déterminer la concentration. C'est la principale raison pour laquelle ils sont appelés concentrations chimiques.
Ensuite, les différentes formules sont présentées pour calculer les quatre concentrations chimiques les plus couramment utilisées:
Molarité (M)
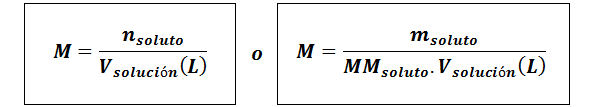
Oùsoluté Ce sont les moles de soluté, msoluté représente la masse du soluté en grammes, mmsoluté est sa masse molaire et Vsolution C'est le volume de la solution en litres.
MOLALITÉ (M)
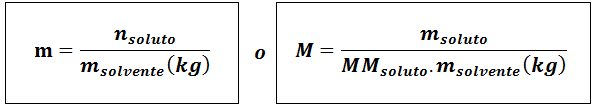
Oùsoluté Ce sont les moles de soluté, msoluté représente la masse du soluté en grammes, mmsoluté C'est sa masse molaire et msolvant C'est la masse du solvant en kilogrammes.
Peut vous servir: solvatationFraction molaire (x)
La fraction molaire peut être calculée à la fois pour le soluté et le solvant. La fraction molaire du soluté est:
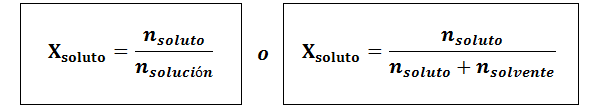
Le solvant est:
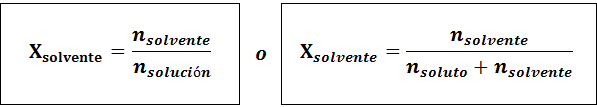
La relation entre les deux fractions molaires est:
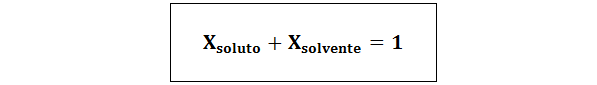
Dans tous les cas nsoluté, nsolution et nsolvant sont les moles de soluté, de solution et de solvant respectivement.
Normalité (n)
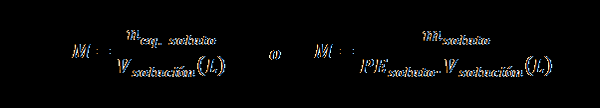
Ici négaliseur. soluté représente le nombre d'équivalent du soluté, msoluté représente la masse du soluté, PEsoluté C'est le poids équivalent du soluté et Vsolution C'est le volume de la solution en litres.
Exemples de concentration chimique
- La concentration de sel dans l'eau marine est de 35 g / L, ce qui correspond à une molarité de 0,60 mol / L.
- La concentration de glycémie moyenne se situe entre 82 mg / dl et 110 mg / dl. Ces concentrations sont équivalentes à un titre simple à 0,82 g / L et 1,10 g / L, et en molarité à 4,4.dix-3 mol / l et 6.1.dix-3 mol / L, respectivement.
- L'air peut être considéré comme une solution gazeuse formée principalement par l'azote et l'oxygène, le solvant étant de l'azote, car il est plus proportionnel. Cette solution de gaz contient une fraction d'oxygène et d'azote 0,22 d'environ 0,78.
- L'acier est un alliage entre le fer et le carbone. Bien qu'ils ne soient pas des solutions strictement, ce sont des mélanges solides homogènes qui contiennent généralement une concentration en carbone de l'ordre de 0,03% et 1 075% en masse.
- Malgré ses effets dévastateurs pour l'environnement et pour la santé des êtres humains, les concentrations de nombreux polluants sont généralement considérablement faibles. Un exemple est la concentration maximale de métal toxique d'arsenic dans l'eau. L'Organisation mondiale de la santé (OMS) a établi que l'eau potable ne devrait pas contenir une concentration d'arsenic supérieure à 10 ppb m / v (parties par milliard ou nanogrammes par litre). Cette concentration équivaut à 0.010 ppm m / v.
Les références
- BBC (s. F.). Concentration des solutions - Calculs en chimie - AQA - GCSE Chemistry (Single Science) Revue - AQA. BBC prise.co.ROYAUME-UNI.
- Voici ce que signifie la concentration en chimie (2020). Taked de Thoughtco.com.
- Libretsexts (2022). 4.5: concentration de solutions. Tiré de Chem.Bibliothèque.org.
- Mandal, un., MARYLAND. (2021). Valeur de glycémie normale. Tiré de nouvelles-médicaux.filet.
- Produits chimiques.Net (s. F.). Concentrations chimiques. Tiré de la chimie.filet.

