Formation de composés binaires, types, exemples, nomenclature
- 1501
- 93
- Mlle Ambre Dumont
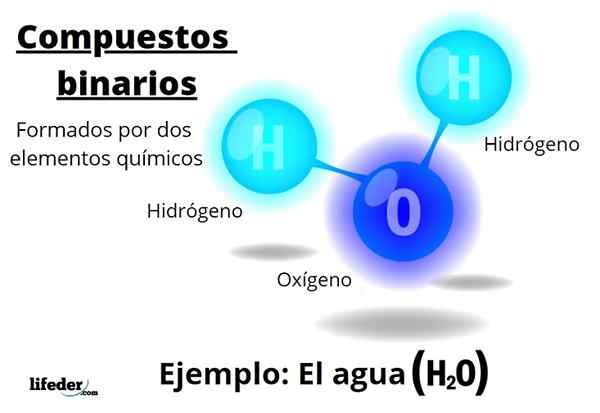
Les composés binaires Ils sont tous formés par deux éléments chimiques, quel que soit le nombre de leurs atomes ou leurs interactions. La formule générale de ces composés estnBm, où a et b sont deux éléments différents du tableau périodique, et n et m leurs coefficients stoechiométriques respectifs.
Par exemple, eau, h2Ou, c'est un composé binaire, être peut-être le plus représentatif d'entre eux. L'eau se compose d'hydrogène, de H et d'oxygène, ou, ajoutant ainsi deux éléments chimiques. Notez que ses coefficients stoechiométriques indiquent qu'il existe deux atomes d'hydrogène et d'oxygène, mais c'est toujours un composé binaire.

Les composés binaires peuvent être composés d'ions, de molécules, de réseaux à trois dimensions ou même d'atomes de métaux neutres. L'important est que quelle que soit la nature de sa liaison chimique ou sa composition est toujours formée par deux éléments chimiques différents. Par exemple, l'hydrogène gazeux, h2, ne compte pas comme un composé binaire.
Les composés binaires peuvent ne pas sembler, initialement, si abondants et complexes par rapport aux composés ternaires ou quaternaires. Cependant, parmi eux se trouvent de nombreuses substances essentielles pour les écosystèmes terrestres, tels que les sels, les oxydes, les sulfures et certains gaz de valeur biologique et industrielle immense.
[TOC]
Comment sont les composés binaires?
Les méthodes de préparation ou les voies synthétiques pour former des composés binaires dépendront de l'identité des deux éléments chimiques A et B. Cependant, en principe et en général, les deux éléments doivent être combinés dans un réacteur afin qu'ils puissent interagir les uns avec les autres. Ainsi, si les conditions sont favorables, une réaction chimique aura lieu.
Ayant une réaction chimique, les éléments A et B se joindront ou se lieront (ionique ou covalente) pour former le composé pournBm. De nombreux composés binaires peuvent être formés par une combinaison directe de leurs deux éléments purs, ou suivre d'autres méthodes alternatives plus économiquement viables.
Il peut vous servir: oxyde de zinc (ZnO): structure, propriétés, utilisations, risquesRetour à l'exemple de l'eau, hydrogène, h2, et oxygène, ou2, Ils se combinent à des températures élevées afin qu'il y ait une réaction de combustion entre eux:
2h2(g) + ou2(g) → 2h2O (g)
L'eau, en revanche, peut être obtenue par des réactions de déshydratation de composés tels que les alcools et les sucres.
Un autre exemple de formation d'un composé binaire correspond au sulfure ferreux, Fes:
Foi (s) + s (s) → fes (s)
Où cette fois, le fer et le soufre sont solides et non des substances de soda. Et c'est la même chose avec plusieurs sels binaires, par exemple, le chlorure de sodium, le NaCl, combinant du sodium métallique avec des gaz de chlore:
2na (s) + cl2(g) → 2NACl (s)
Nomenclature
Les noms de tous les composés binaires sont principalement régis par les mêmes règles.
Pour que le composénBm, Le nom B est mentionné d'abord sous sa forme anionique; c'est-à-dire avec la fin -Uro. Cependant, dans le cas où B se compose d'oxygène, il est nommé comme un oxyde, un peroxyde ou un superoxyde appliqué.
Le nom de B est précédé de préfixes grecs numériques (mono, di, tri, tétra, etc.) selon la valeur de m.
Enfin, le nom de l'élément A est mentionné. Dans le cas où il a plus d'une valence, il est indiqué par des numéros romains et entre parenthèses. Ou si préféré, vous pouvez choisir la nomenclature traditionnelle et utiliser les suffixes -ooso e -ico. L'élément A a parfois également précédé de préfixes numériques grecs en fonction de la valeur de n.
Considérez les composés binaires suivants ainsi que leurs noms respectifs:
-H2O: oxyde d'hydrogène ou monoxyde de dihydrogène (ce nom de famille est une cause de taquineries)
-FES: sulfure de fer (II) ou sulfure ferreux
-NaCl: chlorure de sodium ou chlorure de sodium
Peut vous servir: huile ou éther de benzine: formule, structure, utilisations-MGCL2: chlorure de magnésium, chlorure magnétique ou dichlorure de magnésium
Notez qu'il n'est pas dit «chlorure de monosodium» ou «sulfure de monoonro».
Types: Classification des composés binaires
Les composés binaires sont classés en fonction de ce qui se forme ou des faits: ions, molécules, atomes ou réseaux métalliques. Même ainsi, cette classification n'est pas entièrement concluante ou définitive, pouvoir varier en fonction de l'approche considérée.
Ionique
Dans les composés binaires ioniques, A et B se composent d'ions. Ainsi, pour que le composénBm, B est généralement un anion, b-, Tandis qu'un cation, pour+. Par exemple, NaCl appartient à cette classification, ainsi que tous les sels binaires, dont les formules générales sont mieux représentées comme MX, où X est un anion, et m a Metallic Cation.
Ainsi, les fluorures, les chlorures, les bromuros, l'iodure., Ils appartiennent également à cette classification. Cependant, il convient de noter que certains d'entre eux sont covalents, appartenant ainsi à la classification suivante.
Covalent
Les composés binaires covalents sont formés par des molécules. L'eau appartient à cette classification, car elle se compose de molécules H-O-H. Le chlorure d'hydrogène, HCl, est également considéré comme un composé binaire covalent, car il se compose de molécules H-CL. Notez que le NaCl est ionique, tandis que le HCL est covalent, les deux chlorures étant.
Métalliques ou réseaux
Les composés binaires couvrent également les alliages et les solides de réseaux à trois dimensions. Cependant, pour eux, la dénomination des matériaux binaires est généralement mieux utilisée.
Par exemple, le laiton, plus qu'un composé, est considéré comme un matériau binaire ou un alliage, car il est formé par le cuivre et le zinc, Cu-Zn. Notez qu'il n'est pas écrit en n'ayant pas défini les coefficients stoechiométriques.
De même, il y a du dioxyde de silicium, sio2, formé par le silicium et l'oxygène. Leurs atomes sont liés par la définition d'un réseau à trois dimensions, où vous ne pouvez pas parler de molécules ou d'ions. De nombreux nitrures, phosphon et carbures, lorsqu'ils ne sont pas ioniques, concernent également ce type de réseaux.
Peut vous servir: acide phénoxyacétique: synthèse, procédure, utilisations, risquesExemples de composés binaires
 L'eau est un exemple de composé binaire
L'eau est un exemple de composé binaire Il sera répertorié pour terminer plusieurs composés binaires accompagnés de leurs noms respectifs:
-Liber: bromure de lithium
-Cacl2: chlorure de calcium
-Fecl3: chlorure de fer (iii) ou chlorure ferrique
-Nao: oxyde de sodium
-Bel2: hydrure de béryllium
-CO2: dioxyde de carbone
-NH3: Trihydride d'azote ou d'ammoniac
-PIB2: Diriger l'iodure (II) ou Diyoduro en plomb
-Mg3N2: Nitruro en magnésium
-Au2SOIT3: Oxyde d'aluminium ou trioxyde de diauaum
-N / A3Q: Phosphuro de sodium
-Alf3: Fluorure d'aluminium
-Rabat-temps2: chlorure de radio ou dichlorure de radio
-Petit ami3: Boro trifluoruro
-RBI: Rubidio Yoduro
-WC: carbure de tungstène ou wolframium
Chacun de ces exemples peut avoir plus d'un nom à la fois. Parmi ceux-ci, le CO2 Il a un grand impact sur la nature, car il est utilisé par les plantes dans le processus de photosynthèse.
D'un autre côté, le NH3 C'est l'une des substances ayant la valeur la plus industrielle, nécessaire à la synthèse de la synthèse polymère et organique. Et enfin, le WC est l'un des matériaux les plus difficiles jamais créés.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Artem Cheprasov. (2020). Qu'est-ce qu'un composé binaire? - Définition et exemple. Étude. Récupéré de: étudier.com
- Helmestine, Anne Marie, Ph.D. (11 février 2020). Définition du composé binaire. Récupéré de: Thoughtco.com
- Byju's. (2020). Que sont les composés binaires? Récupéré de: byjus.com
- Chemteam. (s.F.). Composés binaires de métaux avec des charges fixes. Récupéré de: Chemteam.Info
- Wikipédia. (2020). Phase binaire. Récupéré de: dans.Wikipédia.org
- « Propriétés des nitrites, structure, nomenclature, formation
- Floculation de réaction, types, applications, exemples »

