Composé chimique
- 2505
- 635
- Adam Mercier
Nous expliquons en quels composés chimiques consistent, les types qui existent, les différences avec les éléments chimiques et donnent plusieurs exemples.
 Les composés chimiques sont toute cette substance qui a des atomes de deux éléments chimiques différents
Les composés chimiques sont toute cette substance qui a des atomes de deux éléments chimiques différents Qu'est-ce qu'un composé chimique?
UN composé chimique Il s'agit d'une substance formée par l'union de deux atomes ou plus d'éléments chimiques différents. Les composés chimiques restent unis grâce aux liaisons chimiques, qui sont liées aux électrons des atomes liés; c'est-à-dire, dans un composé chimique, les électrons (les plus à l'extérieur) des atomes interviennent dans la formation des liens.
Les composants des composés chimiques (éléments chimiques) ne peuvent pas être séparés les uns des autres par des méthodes physiques, telles que: distillation, centrifugation, filtration, etc., nécessitant des méthodes chimiques en place pour y parvenir.
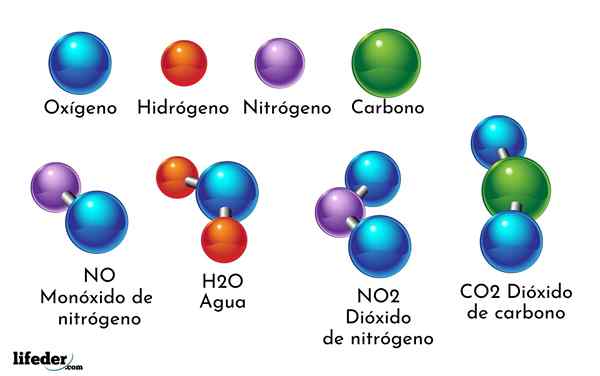
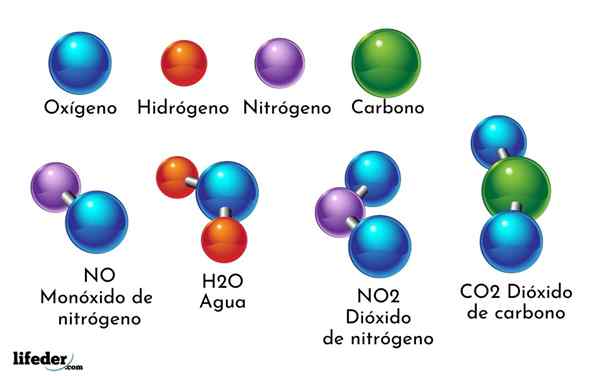
Un exemple de composé chimique est l'eau. Il est formé par seulement deux atomes de deux éléments chimiques différents: l'oxygène et l'hydrogène, ayant la formule chimique H2SOIT. Par conséquent, deux h se lient avec un ou pour former H2SOIT.
Un élément chimique, contrairement aux composés chimiques, est la manière la plus simple et la plus élémentaire qui constitue la matière. Il est présenté comme un type d'atome unique qui ne peut pas être décomposé en substances plus simples par des réactions chimiques.
Types de composés chimiques
Les composés chimiques peuvent être classés principalement en suivant deux critères:
- Selon le type de liaison qui unit les éléments chimiques présents dans le composé chimique.
- Selon la composition et la structure du composé chimique.
Selon le type de lien
Selon le type de lien, les composés chimiques peuvent être:
- Molécules. Ce sont des composés chimiques formés par deux ou plusieurs types d'éléments chimiques différents, qui sont rejoints par une liaison covalente. Ce lien est caractérisé par le partage d'une ou plusieurs paires d'électrons externes, ou Valence, entre deux atomes.
- Ions. Les composés chimiques à charge électrique sont appelés composés chimiques ioniques, et leurs ions sont unis par le lien ionique. Cette liaison se produit lors de la rejoindre un élément chimique du type de métal avec un élément chimique non métallique.
- Composés intermétalliques. C'est un type d'alliage métallique qui constitue un matériau solide qui se situe entre deux ou plusieurs éléments chimiques métalliques pour les maintenir ensemble.
- Coordination. Ils sont formés par un élément métallique central, appelé centre de coordination, et qui entourent un ensemble de molécules ou d'ions unis appelées ligands. L'hémoglobine, par exemple, est une protéine qui se trouve dans les globules rouges et qui transporte l'oxygène dans le sang. L'hémoglobine a un composé de coordination appelé Grupo Hemo. Au centre de l'hémo, il y a un atome de fer qui intervient dans le transport de l'oxygène par l'hémoglobine.
Selon la composition et la structure
Selon ce critère, les composés chimiques sont classés comme organiques et inorganiques.
- Composés organiques. Ce sont des composés dont l'élément chimique principal est le carbone, qui forment généralement des liens avec les atomes du même carbone et hydrogène. Cependant, ils sont également présents, bien que dans une moindre mesure, de l'oxygène, de l'azote, du soufre, du bore, du phosphore, etc. Les composés organiques peuvent être:
- Aliphatique. Les molécules des composés aliphatiques peuvent avoir des formes linéaires ou cycliques, c'est-à-dire dans des formes fermées telles que les triangles, les carrés, les pentagones, etc. Ils peuvent avoir des liaisons de carbone de trois types: simple (C-C), double (c = c) ou triple (C≡C).
- Aromatique. Ce sont des composés cycliques qui présentent alternativement des liaisons en carbone simple et des liaisons à double carbone-carbone.
- Hétérocyclique. Ce sont des composés qui ont une structure cyclique, qui peut présenter le remplacement d'un atome de carbone par un autre élément chimique (O, S, N, etc.).
- Organométallique. Ce sont des composés organiques qui peuvent se présenter dans leurs éléments métalliques de composition.
- Polymères. Ce sont de grandes molécules (macromolécules) qui sont formées par des unités petites et identiques qui sont répétées dans tout le polymère, et qui sont appelées monomères.
- Composés inorganiques. Les composés inorganiques, contrairement à des composés organiques, n'ont pas de carbone comme élément chimique central, mais interviennent plutôt dans leur composition la plupart des éléments chimiques connus. Les composés inorganiques peuvent être:
- Oxydes de base. Ils sont formés par la réaction d'un élément chimique métallique, comme le sodium, le calcium, le fer, le cuivre, etc., Avec de l'oxygène. Par exemple, l'oxyde de sodium (NAO) est un oxyde de base. Ils sont appelés oxydes de base car ils donneront naissance aux bases ou aux hydroxydes.
- Oxydes acides. Ils proviennent de la réaction d'un élément chimique non métallique, comme le chlore, le fluor, le soufre, le brome, etc., Avec de l'oxygène. Par exemple, l'oxyde bromique (Br2SOIT5) C'est un oxyde acide. Ils sont appelés oxydes acides parce qu'ils donnent naissance à des acides.
- Hydrate. Ils présentent dans leur composition chimique la présence d'hydrogène. Il existe deux types: Hydros métalliques et hydrors non métalliques.
- Métal. Ils sont formés par la réaction de l'hydrogène, avec l'état d'oxydation -1, avec un métal. Ces composés chimiques sont les seuls dans lesquels l'hydrogène est présent avec l'état d'oxydation -1. Par exemple, CAH2 C'est de l'hydrure de calcium.
- Pas métallique. Ils sont formés par la réaction de l'hydrogène, avec un état d'oxydation + 1, avec un élément non métallique avec son état d'oxydation inférieur. Le chlore hydrure (HCl) est un gaz qui lorsque l'acide chlorhydrique est dissous dans l'eau.
- Acides. Ce sont des composés chimiques inorganiques, bien qu'il y ait des acides organiques, qui ont un pH inférieur à 7 et se tournent vers la couleur du papier rouge à rouge en rouge. Ils peuvent être classés en hydrycides et oxacides.
- Hydratie. Ils proviennent de la réaction de l'hydrogène avec un non-métal pour former un hydrure qui se dissout dans l'eau provient d'un acide; Par exemple, acide iarhydrique (HI).
- Oxcacides. Il provient de la réaction d'un oxyde d'un élément chimique non métallique avec de l'eau. Par exemple, réaction d'oxyde sulfurique (donc3) Avec l'eau produit de l'acide sulfurique (h2Swin4).
- Vous sortez. Ce sont des composés chimiques qui proviennent de l'interaction de l'acide et des composés de base. Dans sa composition, il peut y avoir autant d'éléments métalliques que non-métalliques. Les sels sont classés comme:
- Sels neutres. Ils proviennent d'une réaction de neutralisation entre un acide et une base avec la formation de sel et d'eau. Par exemple, la réaction d'hydroxyde de sodium (NaOH) avec de l'acide chlorhydrique (HCL) produit du chlorure de sodium (NaCl), du sel et de l'eau. Ils sont appelés neutres car ils ne produisent pas de variation de pH.
- Sels acides. Ils sont formés par la réaction d'un hydroxyde de métal avec Valencia +1, avec un acide avec plusieurs hydrogènes. La réaction de l'hydroxyde de lithium (LIOH) avec de l'acide carbonique (H2CO3), produit le remplacement d'un seul hydrogène par du lithium, ce qui provoque le bicarbonate de lithium (lihco3), Un sel acide et une eau.
- Sels de base. Ils sont produits par la réaction d'une base qui a plus d'un groupe OH avec un acide d'hydratie, par exemple, l'acide chlorhydrique. Lors de la réaction d'acide avec l'hydroxyde de calcium, CA (OH)2, Un atome de chlore remplace un groupe hydroxyle (OH). Cela produit un hydroxychlorure de calcium (Cuckloh), un sel et une eau de base.
Différences entre les composés chimiques et les éléments chimiques
 Sur les éléments chimiques et les composés chimiques. Les composés chimiques sont formés par les éléments ci-dessus
Sur les éléments chimiques et les composés chimiques. Les composés chimiques sont formés par les éléments ci-dessus Chaque élément chimique correspond à un atome spécifique et uniquement avec ce type d'atome; c'est-à-dire qu'un élément chimique n'a pas différents types d'atomes. L'atome est la particule élémentaire de la matière qui n'est pas divisée par des méthodes physiques ou chimiques.
L'atome d'un élément chimique peut être joint aux atomes d'autres éléments chimiques pour former des composés chimiques, qui peuvent être séparés en leurs composants (éléments chimiques) à l'aide de méthodes chimiques.
Les éléments chimiques et les composés chimiques avec un puzzle pourraient être équipés: les pièces de puzzle ont des caractéristiques différentes, afin qu'elles puissent correspondre aux éléments chimiques.
Les pièces de puzzle peuvent se joindre pour former différentes figures. Les chiffres formés pourraient être assimilés aux composés chimiques. Une fois l'activité terminée, les chiffres du puzzle peuvent être séparés en des pièces qui la constituent.
Exemples de composés chimiques
Ci-dessous, vous pouvez voir une série d'exemples de composés chimiques quotidiens:
- HCl: acide chlorhydrique
- H2S: acide sulfhydrique
- HF: acide fluorhydrique
- H2Swin4: Acide sulfurique
- Hclo4: Acide perchlorique
- H3Pote4: Acide phosphorique
- H2CO3: Acide carbonique
- HNO3: Acide nitrique
- NaOH: hydroxyde de sodium
- Ca (oh)2: Hydroxyde de calcium
- Foi (OH)2: Hydroxyde ferreux
- Foi (OH)3: Hydroxyde ferrique
- Non: hydrure de sodium
- Cu2O: oxyde de cuprous
- Cuo: oxyde de cuprique
- Foi2SOIT3: Oxyde ferrique
- CL2SOIT7: Oxyde perchlorique
- BR2O: oxyde hipobro
- Toi2SOIT3: Oxyde d'hypoyodose
- NaCl: chlorure de sodium
- Fecl3: Chlorure ferrique
- HCO3: Bicarbonate de sodium
- Ch3Chemin: acétate de sodium
- N / A2Swin4: Sulfate de sodium
- Feso4: Sulfure ferreux
- H2O: eau
- CO2: Dioxyde de carbone
- C6H12SOIT6: Glucose
- C12H22SOITonze: Saccharose
Autres sujets d'intérêt
Réactions chimiques
Chimie dans la vie quotidienne: exemples
Composés organiques
Composés inorganiques
Liaison chimique
Substances pures
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Wikipédia. (2021). Composé chimique. Récupéré de: dans.Wikipédia.org
- Helmestine, Anne Marie, Ph.D. (27 août 2020). Définition composée en chimie. Récupéré de: Thoughtco.com
- Toppr. (s.F.). Qu'est-ce que composé en chimie? Types de composés chimiques. Récupéré de: toppr.com

