Acide sulfureux
- 1008
- 201
- Anaïs Julien
 L'acide sulfureux est un acide minéral qui se produit lorsque le dioxyde de soufre se dissout dans l'eau
L'acide sulfureux est un acide minéral qui se produit lorsque le dioxyde de soufre se dissout dans l'eau Qu'est-ce que l'acide sulfureux?
Il Acide sulfureux C'est un oxácido qui se forme lorsque le dioxyde de soufre, donc2, se dissout dans l'eau. Il s'agit d'un acide inorganique faible et instable, qui n'a pas pu être détecté en solution, car la réaction de sa formation est réversible et l'acide se décompose rapidement dans les réactifs qui l'ont produit (donc2 et h₂o).
Il s'agit d'un liquide incolore, avec une forte odeur de soufre, instable, et est utilisé dans divers champs industriels, tels que des matériaux tachés de chlore, pour la synthèse de produits médicinaux et chimiques, pour la fabrication de papier ou pour affiner les dérivés du pétrole.
La molécule d'acide de soufre en ce moment n'a été détectée que dans la phase gazeuse. Les bases conjuguées de cet acide sont des anions courants sous les formes de sulfites et de bisulfite.
Le spectre de SO de Raman2 Il ne montre que des signes en raison de la molécule SO2 et Bisulfite Ion, HSO3-, Conformément à l'équilibre suivant:
Swin2 + H₂o HSO3- + H+
Cela indique que par spectre de Raman, ce n'est pas possible.
Lorsqu'il est exposé à l'atmosphère, il est rapidement transformé en acide sulfurique. L'acide sulfureux est réduit en sulfure d'hydrogène en raison de l'action de l'acide sulfurique dilué et du zinc.
La tentative de concentrer une solution SO2 Par évaporation de l'eau pour obtenir l'acide soufre sans eau, il n'a pas produit de résultat, car l'acide se décompose rapidement (investir la réaction de formation), donc l'acide ne peut pas être isolé.
Structure de Acide sulfureux
 Structure chimique de l'acide sulfureux
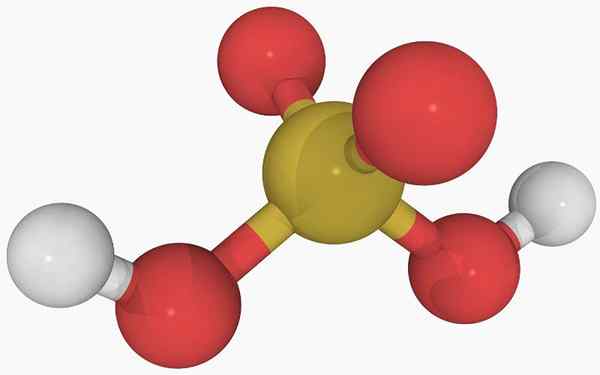
Structure chimique de l'acide sulfureux Dans l'image principale, la structure d'une molécule isolée d'acide sulfureux dans un état gazeux peut être observée. La sphère jaune au centre correspond à l'atome de soufre, aux rouges aux atomes d'oxygène et aux hydrogènes blancs à.
Peut vous servir: diastréomèresSa géométrie moléculaire autour de l'atome S est une pyramide trigonale, avec les atomes ou dessiner la base.
Puis, à l'état gazeux, les molécules H2Swin3 Ils peuvent être considérés comme des pyramides trigonales microscopiques flottant dans l'air, en supposant qu'ils sont suffisamment stables pour durer un certain temps sans réagir.
La structure indique clairement d'où proviennent les deux hydrogènes acides: des groupes hydroxyles liés au soufre, Ho-Oh-OH. Par conséquent, pour ce composé, il n'est pas correct de supposer que l'un des protons acides, H+, est libéré de l'atome de soufre, H-SO2(OH).
Les deux groupes OH permettent à l'acide de soufre d'interagir en utilisant des ponts d'hydrogène, et également l'oxygène de la liaison S = O est un accepteur d'hydrogène, ce qui fait H2Swin3 à la fois dans un bon donateur et accepteur de ces ponts.
Selon ce qui précède, H2Swin3 Je devrais pouvoir condenser dans un liquide, comme le fait l'acide sulfurique, h2Swin4. Néanmoins, ce n'est pas comme ça que ça se passe.
Propriétés physiques et chimiques du Acide sulfureux
Formule moléculaire
H2Swin3
Poids moléculaire
82.073 g / mol.
Aspect physique
C'est un liquide incolore, avec une odeur de soufre épicée.
Densité
1.03 g / ml.
Densité de vapeur
2.3 (par rapport à l'air pris comme 1)
Corrosivité
Il est corrosif pour les métaux et les tissus.
Solubilité dans l'eau
Miscible.
Sensibilité
C'est sensible à l'air.
La stabilité
Stable, mais incompatible avec des bases fortes.
Constante d'acidité (ka)
1.54 x 10-2
Pka
1.81
pH
1.5 sur l'échelle de pH.
point d'allumage
Pas inflammable.
Décomposition
Lorsqu'il est chauffé, l'acide soufre peut être décomposé, émettant une fumée toxique d'oxyde de soufre.
Peut vous servir: hydroxyde de chrome: structure, propriétés, synthèse, utilisationsNomenclature
Le soufre a les valences suivantes: ± 2, +4 et +6. De la formule H2Swin3, Il peut être calculé quel numéro de valence ou d'oxydation a du soufre dans le composé. Pour ce faire, il suffit de résoudre une somme algébrique:
2 (+1) + 1v + 3 (-2) = 0
Comme c'est un composé neutre, la somme des charges des atomes qui constituent qu'elle doit être 0. Effacer V pour l'équation précédente, vous avez:
V = (6-2) / 1
Ainsi, v est égal à +4. C'est-à-dire que le soufre participe avec son deuxième Valence, et selon la nomenclature traditionnelle, le suffixe doit être ajouté au nom -ooso. Pour cette raison, à h2Swin3 Il est connu sous le nom d'acide de soufreours.
Un autre moyen plus rapide de déterminer ce Valencia, consiste à comparer H2Swin3 avec h2Swin4.
En h2Swin4 Le soufre a Valencia +6, donc si un ou, Valencia descend à +4, et si un autre est retiré, Valencia descend à +2 (ce qui serait le cas pour l'acide hoquetSoufreours, H2Swin2).
Bien que moins connu, à h2Swin3 Il peut également être appelé acide trioxosulfurique (IV), selon la nomenclature des stocks.
Formation d'acide sulfureux dans la nature
L'acide sulfureux est formé dans la nature en raison de la combinaison de dioxyde de soufre, produit de l'activité des grandes usines, avec de l'eau atmosphérique.
Pour cette raison, il est considéré comme un produit intermédiaire de pluie acide, causant de grands dommages à l'agriculture et à l'environnement.
La synthèse
Techniquement, le soufre est formé pour former du dioxyde de soufre. Ensuite, il se dissout dans l'eau pour former l'acide soufre. Cependant, la réaction est réversible et l'acide se rompt rapidement dans les réactifs.
Ceci est une explication des raisons pour lesquelles l'acide soufre ne se trouve pas dans une solution aqueuse (comme déjà mentionné dans la section de sa structure chimique).
Peut vous servir: loi de bière-lambbeApplications
Généralement, les utilisations et les applications de l'acide sulfureux, car sa présence ne peut pas être détectée, se référer aux utilisations et applications des dioxydes de soufre et de la base et des sels d'acide.
En bois
Dans le processus de sulfite, la pulpe en bois sous la forme de fibres de cellulose presque pure se produit. Plusieurs sels d'acide soufre sont utilisés pour l'extraction de la lignine des éclats de bois, en utilisant des conteneurs à haute pression appelés digesteurs.
Agent désinfectant
L'acide sulfureux est utilisé comme désinfectant.
Eau de Javel
Il est également utilisé comme blanchiment doux, en particulier pour les matériaux sensibles au chlore. De plus, il est utilisé comme blanchie dentaire et additif alimentaire.
Produits de beauté
C'est un ingrédient de divers cosmétiques pour les soins de la peau et a été utilisé comme élément de pesticide dans l'élimination des rats. Élimine les taches causées par le vin ou les fruits sur différents tissus.
Antiseptique
Il sert d'antiseptique, étant efficace pour éviter les infections cutanées. À certains moments, il a été utilisé dans les fumigations pour désinfecter les navires, les effets personnels des victimes d'épidémies, etc.
Agent de conservateur
L'acide du soufre est utilisé comme conservateur des fruits et légumes et pour éviter la fermentation de boissons telles que le vin et la bière, étant un élément antioxydant, antibactérien et fongicide.
Produits chimiques
L'acide sulfureux est utilisé dans la synthèse des médicaments et des produits chimiques, dans l'élaboration du vin et de la bière, dans le raffinement des produits dérivés de l'huile, et comme réactif analytique.
Les références
- Nomenclature des acides. Récupéré de 2.Chimie.Gattech.Édu
- Calvo Flores, F. g. Formulation de chimie inorganique. UGR a récupéré.est

