Structure du carbonate de zinc (ZnCO3), propriétés, utilisations

- 2264
- 428
- Raphaël Charles
Il carbonate de zinc Il s'agit d'un composé inorganique formé par les éléments de zinc (Zn), de carbone (C) et d'oxygène (O) (O). Sa formule chimique est Znco3. Le zinc a un état d'oxydation de +2, du carbone +4 et de l'oxygène -2.
C'est un solide incolore ou blanc que l'on trouve dans la nature formant le minéral Smithsonite, dans lequel il peut être seul ou avec d'autres éléments tels que le cobalt ou le cuivre, qui lui donnent respectivement une coloration violette ou verte.
 Smithsonita, Znco Mineral3. Rob Lavinsky, Irocks.com-cc-by-sa-3.0 / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons.
Smithsonita, Znco Mineral3. Rob Lavinsky, Irocks.com-cc-by-sa-3.0 / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons. Le znco3 Il est presque insoluble dans l'eau, mais il est facilement dissous dans les acides dilués, comme l'ion carbonate en forme carbononique acide (H2CO3), qui devient alors le gaz co2 et de l'eau.
Il est utilisé comme antiseptique dans les blessures animales et est parfois fourni dans le régime alimentaire pour éviter les maladies causées par une carence en zinc.
Il sert à retarder la brûlure que certaines fibres, plastiques et gencives lorsqu'ils entrent en contact avec le feu. Permet de séparer les minéraux toxiques d'arsenic des autres roches en toute sécurité.
Il a été utilisé dans les pâtes dentifriques pour récupérer la dentine dans les dents sous blanchiment.
[TOC]
Structure
Le znco3 Il est formé par un cation Zn2+ et un Anion Co32-. Le carbone dans l'ion carbonate a un état d'oxydation de +4. Cet ion a une structure plate avec les trois atomes d'oxygène entourant l'atome de carbone.
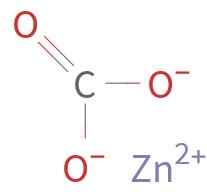 Structure chimique du carbonate de zinc. Auteur inconnu / domaine public. Source: Wikimedia Commons.
Structure chimique du carbonate de zinc. Auteur inconnu / domaine public. Source: Wikimedia Commons. Nomenclature
- Carbonate de zinc
- Monocarbonate de zinc
- Sel de zinc d'acide carbonique
- Smithsonita
- Crachat de zinc
Propriétés
État physique
Solide incolore ou blanc cristallin. Cristaux rombiques.
 Carbonate de zinc. Ondřej Mangl / Pub Domain. Source: Wikimedia Commons.
Carbonate de zinc. Ondřej Mangl / Pub Domain. Source: Wikimedia Commons. Poids moléculaire
125,4 g / mol
Point de fusion
À 140 ºC, il se décompose sans fondre.
Densité
4 398 g / cm3 à 20 ° C.
Solubilité
Pratiquement insoluble dans l'eau: 0,000091 g / 100 g de h2Ou à 20 ° C. Soluble dans les acides dilués, les alcalis et les sels d'ammonium. Insoluble dans l'ammoniac, l'alcool et l'acétone.
Propriétés chimiques
Réagit avec les acides formant du dioxyde de carbone:
Znco3 + 2 h+ → Zn2+ + H2Ou + CO2↑
Il se dissout dans des bases formant l'hydroxyde, qui est partiellement dissoute formant un ion de zincato:
Peut vous servir: Bromine: historique, structure, configuration électronique, propriétés, utilisationsZnco3 + 2 oh- → Zn (OH)2 + CO32-
Zn (OH)2 + H2Ou + oh- → [Zn (OH)3(H2SOIT)]-
Ce n'est pas inflammable. Lorsqu'il est chauffé à sa décomposition produit de l'oxyde de zinc et du dioxyde de carbone, mais peut émettre du monoxyde de carbone (CO).
Znco3 + Chaleur → ZnO + CO2↑
Obtention
Le Smithsonite Mineral est obtenu, anciennement appelé Zinc's SchAt.
Il peut également être préparé en mélangeant une solution de carbonate de sodium avec un sel de zinc, comme le sulfate de zinc. Le sulfate de sodium reste dissous et le carbonate de zinc précipite:
ZNSO4 + N / A2CO3 → Znco3↓ + na2Swin4
Applications
Dans les traitements médicaux
Ce composé vous permet d'obtenir des produits pharmaceutiques. Il est appliqué sur la peau enflammée sous forme de poussière ou de lotion.
Dans les applications vétérinaires
Le znco3 Il sert de protecteur astringent, antiseptique et topique des animaux chez les animaux.
Il permet également de prévenir les maladies causées par une carence en zinc, il est donc utilisé comme complément dans l'alimentation de certains animaux, à condition que les quantités administrées se trouvent dans les normes établies par les agences de santé.
 Le carbonate de zinc est parfois administré en micronutriment pour éviter les maladies chez les porcs. Auteur inconnu / CC0. Source: Wikimedia Commons.
Le carbonate de zinc est parfois administré en micronutriment pour éviter les maladies chez les porcs. Auteur inconnu / CC0. Source: Wikimedia Commons. Dans les épidémies de porcheratose chez les porcs, il s'ajoute au régime alimentaire de ces. Cette maladie est une altération de la peau dans laquelle la couche de cornée n'est pas correctement formée.
Comme ignifuge
Il est utilisé comme remplissage ignifuge pour le caoutchouc et les plastiques exposés à des températures élevées. Vous permet de protéger les fibres textiles du feu.
Dans le cas des textiles de coton, il est appliqué au tissu avec des alcalins. Cela attaque directement les groupes hydroxyles primaires (-ch2Oh) de cellulose et les rend sodiocellulose (-ch2SUR UN).
La rupture des liaisons de cellulose par l'alcali favorise une plus grande pénétrabilité des chaînes de la structure cellulosique compacte, de sorte que plus de quantité ZnCO3 parvient à entrer dans la zone amorphe de cette dispersion et sa dispersion est facilitée.
Peut vous servir: Vanadium: histoire, propriétés, structure, utilisations Certains tissus de coton peuvent contenir du znco3 dans leurs fibres pour les rendre résistants au feu. Socken_farbig.JPEG: Scott Bauererivative Work: chaussette / domaine public. Source: Wikimedia Commons.
Certains tissus de coton peuvent contenir du znco3 dans leurs fibres pour les rendre résistants au feu. Socken_farbig.JPEG: Scott Bauererivative Work: chaussette / domaine public. Source: Wikimedia Commons. En conséquence, la quantité de gaz inflammable qui pourrait se produire avec le feu est réduit.
Dans les traitements dentaires
Certaines crèmes dentifriques à base de nanocristaux de carbonate de zinc et d'hydroxyapatite appliqués régulièrement à la prothèse réduisent l'hypersensibilité plus efficacement que celles basées sur le fluorure.
Les nanocristaux de Znco3 et l'hydroxiapatite ont une taille, une forme, une composition chimique et une cristallinité similaires à celles de la dentine, de sorte que les tubules dentin peuvent être fermés avec l'application de ces matériaux.
 Nanoparticules de Znco3-L'hydroxiapathe a été testée avec succès pour réduire la sensibilité dans les dents blanchies. Auteur: Mélange de photos. Source: Pixabay.
Nanoparticules de Znco3-L'hydroxiapathe a été testée avec succès pour réduire la sensibilité dans les dents blanchies. Auteur: Mélange de photos. Source: Pixabay. Ce type de pâtes dentifriques a été utile après les processus de blanchiment dentaire.
Pour séparer les minéraux d'arsenic dangereux
Les méthodes de minéraux en arsenic de roches de soufre (comme la galène, la chalcopyrite et la pyrite) ont été testées à l'aide de ZNCO)3. Le minerai en arsenic doit être séparé des autres car cet élément est un polluant très toxique et toxique pour les êtres vivants.
Pour y parvenir, le mélange de roches moulues est traité avec une solution de sulfate de zinc et du carbonate de sodium à un pH de 7,5-9,0 et un composé Xantate.
 Arsenopirita. Ce minéral doit être séparé des autres car il contient de l'arsenic toxique. La séparation peut être réalisée avec le carbonate de zinc. James St. John / cc par (https: // CreativeCommons.Org / licences / par / 2.0). Source: Wikimedia Commons.
Arsenopirita. Ce minéral doit être séparé des autres car il contient de l'arsenic toxique. La séparation peut être réalisée avec le carbonate de zinc. James St. John / cc par (https: // CreativeCommons.Org / licences / par / 2.0). Source: Wikimedia Commons. L'efficacité de la formule est attribuée à la formation de petites particules de Znco3 À la surface de l'arsénopyrite, ce qui le rend hydrophile (lié à l'eau), vous ne pouvez donc pas adhérer aux bulles d'air et ne peut pas flotter, précipiter et se séparer des autres minéraux.
En obtenant d'autres composés de zinc
Le carbonate de zinc a été utilisé pour obtenir des nanostructures hydrophobes du borate de formule 3zno • 3b2SOIT3• 3.5h2SOIT. Ce matériau peut être utilisé comme additif ignifuge dans les polymères, le bois et les textiles.
Dans la récupération du zinc des effluents résiduels
Des eaux synthétiques riches sur les ions de zinc rejetées par des processus d'électrodéposition peuvent être traitées par technologie de lit fluidisé utilisant du carbonate de sodium pour précipiter le ZNCO3.
Peut vous servir: alcool secondaire: qu'est-ce que la structure, les propriétés, les utilisationsLorsque le Zn précipite2+ Sous la forme de carbonate diminue sa concentration, le solide obtenu est filtré et les eaux peuvent être jetées en toute sécurité. Le znco3 Le précipité est une grande pureté.
Autres applications
Permet de préparer d'autres composés de zinc. Il est utilisé dans les cosmétiques. Il sert de pigment et est utilisé dans la fabrication de porcelaine, de céramique et de poterie.
Des risques
Inhalation de poussière de Znco3 Cela peut provoquer la décision, la toux, la poitrine, la fièvre et la transpiration d'inconfort. Son ingestion produit des nausées et des vomissements.
Effets sur l'environnement
Le principal risque est son effet sur l'environnement, il doit donc être évité d'être dispersé dans ce. Il est très toxique pour la vie aquatique avec des conséquences qui durent dans les organismes vivants.
Les références
- OU.S. Bibliothèque nationale de médecine. (2019). Carbonate de zinc. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Diriger, D.R. (éditeur) (2003). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- Sharma, V. et al. (2018). Synthèse des nanoneedles de carbonate de zinc, à une flamme potentielle issue des textiles de coton. Cellulose 25, 6191-6205 (2018). Lien récupéré.Springer.com.
- Guan, et. et al. (2020). Colloïdal ZnCO3 comme un puissant dépresseur de l'arsénopyrite dans une pulpe faiblement alcaline et le mécanisme d'interaction. Minerals 2020, 10, 315. MDPI a récupéré.com.
- Maladies de la peau, des yeux, de la conjonctive et de l'oreille externe. (2017). En médecine vétérinaire (onzième édition). Récupéré de ScienceDirect.com.
- Hannig, m. et Hannig, C. (2013). Nanobiomatériaux en dentisterie préventive. En nanobiomatériaux en dentisterie clinique. Chapitre 8. Récupéré de ScienceDirect.com.
- Tugrul, n. et al. (2015). Synthèse des nanostructures hydrophobes du zinc Borrate du carbonate de zinc et caractérisation du produit. Res Chem Intermediate (2015) 41: 4395-4403. Lien récupéré.Springer.com.
- Luna, m.D.g., et al. (2020). Récupération des granules de zinc à partir des eaux usées d'électroples synthétiques à l'aide d'un processus de cristallisation homogène fluidisé. Int. J. Environnement. SCI. Technol. 17, 129-142 (2020). Lien récupéré.Springer.com.
- « Caractéristiques des propositions particulières et universelles
- Quel est le processus économique? Étapes et exemples »

