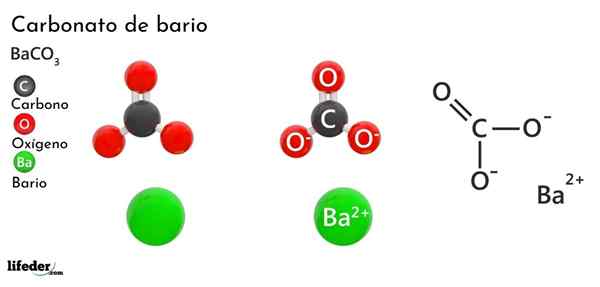
Carbonate de baryum (BACO3)
- 3502
- 217
- Raphaël Charles
Qu'est-ce que le carbonate de baryum?
Il carbonate de baryum Il s'agit d'un sel inorganique du Bario en métal, avant-dernier élément du groupe 2 du tableau périodique et qui appartient aux métaux alcalinotherres. Sa formule chimique est Bacchus3 Et il est disponible sur le marché sous forme de poussière cristalline blanche.
Comment est-il obtenu? Le baryum métallique se trouve dans les minéraux, comme la baryte (Baso4) et le whiterite (Bacchus3). Whiterite est associé à d'autres minéraux qui restent des niveaux de pureté à ses cristaux blancs en échange de colorations.
Pour générer des bacchus3 D'utilisation synthétique, il est nécessaire d'éliminer les impuretés de la Whiterite, comme indiqué par les réactions suivantes:
Bacchus3(s, impur) + 2nh4Cl (s) + q (chaleur) => bacl2(aq) + 2nh3(g) + h2Ou (l) + co2(g)
Bacl2(aq) + (NH4)2CO3(s) => Bacchus3(s) + 2NH4CL (aq)
Le Barita, cependant, est la principale source de baryum, et c'est pourquoi les productions industrielles des composés de baryum commencent à partir de ce. Ce minéral synthétise le sulfure de baryum (BAS), un produit à partir duquel la synthèse d'autres composés et Bacchus coule3:
Bas (s) + na2CO3(s) => Bacchus3(s) + na2H.H)
Bas (s) + co2(g) + h2Ou (l) => bacchus3(s) + (NH4)2S (aq)
Propriétés de carbonate de baro
 Poussière de carbonate de baryum
Poussière de carbonate de baryum C'est un poussiéreux, blanc et cristallin. Il s'agit de toilettes, de démêlage et son poids moléculaire est de 197,89 g / mol. Il a une densité de 4,43 g / ml et une pression de vapeur non existante.
Il a des taux de réfraction de 1 529, 1 676 et 1 677. Le witherita émet une lumière lorsqu'il absorbe le rayonnement ultraviolet: d'une lumière blanche brillante avec des tons bleuâtre, à une lumière jaune.
Il est très insoluble dans l'eau (0,02 g / L) et dans l'éthanol. En HCL Acid Solutions forme le sel de chlorure de bario soluble (BACL2), ce qui explique sa solubilité dans ces milieux acides. Dans le cas de l'acide sulfurique, précipite comment la base de sel insoluble4.
Peut vous servir: oxyde de béryl (Beeo)Bacchus3(s) + 2hcl (aq) => bacl2(aq) + co2(g) + h2Ou (l)
Bacchus3(s) + h2Swin4(aq) => baso4(S) + CO2(g) + h2Ou (l)
Comme c'est un solide ionique, il est également insoluble dans les solvants apolaires. Le carbonate de baryum fond à 811 ºC; Si la température augmente autour de 1380-1400 ºC, le liquide salé souffre d'une décomposition chimique au lieu de l'ébullition. Ce processus se produit pour tous les carbonates métalliques: MCO3(s) => mo (s) + co2(g).
Décomposition thermique
Bacchus3(s) => bao (s) + co2(g)
Si les solides ioniques sont caractérisés par un très stable, pourquoi les carbonates se décomposent-ils? Le métal change-t-il la température à laquelle le solide se décompose? Les ions qui composent le carbonate de baryum sont BA2+ et Cie32-, Les deux volumineux (c'est-à-dire avec de grandes radios ioniques). Le CO32- Il est responsable de la décomposition:
CO32-(s) => o2-(g) + CO2(g)
L'ion oxyde (ou2-) Le métal est lié au métal, oxyde métallique. MO génère une nouvelle structure ionique dans laquelle, en règle générale, plus la taille de ses ions est similaire, plus la structure résultante est stable (enthalpie du réseau). L'inverse se produit si les ions m+ je2- Ils ont des radios ioniques très inégales.
Si l'enthalpie du réseau est grand, la réaction de décomposition est énergiquement favorisée, nécessitant des températures de chauffage plus basses (points d'ébullition inférieurs) mineurs).
D'un autre côté, si Mo a une petite enthalpie de réseau (comme dans le cas de Bao, où BA2+ Il a une plus grande radio ionique que ou2-) La décomposition est moins favorisée et nécessite des températures plus élevées (1380-1400ºC). Dans les cas MGCO3, Voleur3 et SRCO3, Ils se décomposent à des températures plus basses.
Peut vous servir: Magnésium: histoire, structure, propriétés, réactions, utilisationsStructure chimique
L'Anion Co32- Il a une double liaison résonnant entre trois atomes d'oxygène, deux d'entre eux sont chargés négativement pour attirer le cation ba2+.
Alors que les deux ions peuvent être considérés comme des sphères chargées, le CO32- Il a une géométrie trigonale plate (le triangle plat dessiné par les trois atomes d'oxygène), éventuellement un "pad" négatif pour le BA2+.
Ces ions interagissent électrostatiquement pour former un arrangement cristallin d'un type ortorrhrombique, étant les liaisons à prédominance ionique.
Dans ce cas, pourquoi le bacchus n'est-il pas soluble3 Dans l'eau? L'explication est simplement basée sur le fait que les ions sont mieux stabilisés dans le réseau cristallin, que hydraté par des couches moléculaires sphériques d'eau.
Sous un autre angle, les molécules d'eau rendent difficile la surmonter des attractions électrostatiques fortes entre les deux ions. Dans ces réseaux cristallins, ils peuvent abriter des impuretés qui donnent de la couleur à leurs cristaux blancs.
Applications
À première vue, une partie Bacchus3 Il peut ne pas promettre une application pratique dans la vie quotidienne, mais s'il y a un cristal du minéral blancte, blanc comme le lait, commence à comprendre pourquoi sa demande économique.
Est utilisé pour fabriquer du verre de baryum ou comme additif pour les renforcer. Il est également utilisé dans la fabrication de verre optique.
En raison de son grand réseau et de son enthalpie d'insolubilité, il est utilisé dans la fabrication de différents types d'alliages, caoutchoucs, vannes, planchers de planchers, peintures, céramiques, lubrifiants, plastiques, graisses et ciments.
Il est également utilisé comme venin pour les souris. En résumé, ce sel est utilisé pour produire d'autres composés baryum et servir donc de matériaux de dispositifs électroniques.
Peut vous servir: acide sulfanyl: structure, propriétés, synthèse, utilisationsLe bacchus3 Il peut être synthétisé sous forme de nanoparticules, exprimant de très petites échelles de nouvelles propriétés intéressantes de Whiterite. Ces nanoparticules sont utilisées pour imprégner les surfaces métalliques, en particulier les catalyseurs chimiques.
Il s'est avéré améliorer les catalyseurs d'oxydation, et cela favorise en quelque sorte la migration des molécules d'oxygène par sa surface.
Ils sont considérés comme des outils pour accélérer les processus dans lesquels l'oxygène est incorporé. Et enfin, ils sont utilisés pour synthétiser les matériaux supramoléculaires.
Des risques
Le bacchus3 Il est toxique en raison de l'ingestion, provoquant une infinité de symptômes désagréables qui entraînent la mort en raison d'une insuffisance respiratoire ou d'un arrêt cardiaque; Pour cette raison, il n'est pas recommandé d'être transporté à côté des produits comestibles.
Il produit des rougeurs des yeux et de la peau, en plus de la toux et de la douleur à la gorge. C'est un composé toxique, bien que facilement manipulable à mains nues si son ingestion est évitée à tout prix.
Il n'est pas inflammable, mais à des températures élevées, il se décompose en formant Bao et CO2, Produits toxiques et oxydants qui peuvent faire brûler d'autres matériaux.
Dans l'organisme, le baryum est déposé dans les os et autres tissus, supplantant le calcium dans de nombreux processus physiologiques. Il bloque également les canaux où les k ions voyagent+, Empêcher sa diffusion à travers les membranes cellulaires.
Les références
- Se publier. (2018). Carbonate de baryum. Récupéré le 24 mars 2018 de PubChem: PubChem.NCBI.NLM.NIH.Gouvernement
- Wikipédia. (2017). Carbonate de baryum. Récupéré le 24 mars 2018 de Wikipedia: en.Wikipédia.org
- Livre chimique. (2017). Carbonate de baryum. Récupéré le 24 mars 2018 de ChemicalBook: ChemicalBook.com
- Robbins Manuel A. (1983).Robbins Le livre du collection de minéraux fluorescents. Description des minéraux fluorescents, P-117.
- Fhiver & Atkins. (2008). Chimie inorganique. Dans La structure des solides simples (quatrième édition., p. 99-102). Mc Graw Hill.