Historique de Boro, propriétés, structure, utilisations

- 1092
- 291
- Noa Da silva
Il bore C'est un élément non métallique qui dirige le groupe 13 du tableau périodique et est représenté avec le symbole chimique B. Son nombre atomique est de 5 et est le seul élément non métallique de son groupe; Bien que certains produits chimiques le considèrent comme un métalloïde.
Il est présenté comme une poudre brun noirâtre et est dans une proportion de 10 ppm par rapport à la croûte terrestre. Ce n'est donc pas l'un des éléments les plus abondants.
 Échantillon de boro avec pureté d'environ 99%. Source: alajhasha [cc by-sa 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]
Échantillon de boro avec pureté d'environ 99%. Source: alajhasha [cc by-sa 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] Il fait partie de plusieurs minéraux tels que le borax ou le borate de sodium, ce qui est le minéral de bore le plus courant. Il y a aussi la kurnite, une autre forme de borré de sodium; Colemanite ou borate de calcium; et l'ulexite, le sodium et le borato en calcium.
Les boratos sont extraits aux États-Unis, au Tibet, en Chine et au Chili avec une production mondiale d'environ deux millions de tonnes par an.
Cet élément a treize isotopes, étant le plus abondant onzeB, qui représente 80,1% du bore et le dixB, qui forme les 19,9% restants.
Le bore est une trace essentielle pour les plantes, intervenant dans la synthèse de certaines protéines végétales et contribue à l'absorption d'eau. Chez les mammifères, il semble nécessaire pour la santé des os.
Bien que le bore ait été découvert en 1808 par le chimiste anglais Sir Humphry Davy, et les chimistes français Jacques Thérnard et Joseph Gay-Lussac, depuis le début de notre époque en Chine.
Le bore et ses composés ont de nombreuses utilisations et applications, allant de leur utilisation dans la conservation des aliments, en particulier la margarine et les poissons, jusqu'à ce que l'utilisation dans le traitement des tumeurs cancéreuses du cerveau, de la vessie, de la prostate et d'autres organes et autres organes et autres organes et d'autres organes.
Le bore n'est pas très soluble dans l'eau, mais ses composés sont. Cela pourrait être un mécanisme de concentration du bore, ainsi qu'une source d'empoisonnement avec l'élément.
[TOC]
Histoire
Antécédents
Depuis les temps éloignés, l'homme a utilisé des composés de bore dans diverses activités. El Borax, un minéral connu sous le nom de Tincal, a été utilisé en Chine en 300 jours en année.C. dans l'élaboration des céramiques d'émail.
L'alchimiste persan (865-925) a fait la première mention des composés boro. Rhazes a classé les minéraux en six classes, dont l'une était les borocies qui comprenaient du boron.
Agricola, vers 1600, a signalé l'utilisation du borax comme flux de métallurgie. En 1777, la présence d'acide borique dans un courant de sources chaudes près de Florence a été reconnue.
Découverte de l'élément
Humphry Davy, par l'électrolyse d'une solution borax, a observé l'accumulation d'un précipité noir dans l'une des électrodes. Il a également réchauffé l'oxyde de bore (b2SOIT3) Avec du potassium, produisant une poudre brune noirâtre qui était la forme connue de bore.
Gay-Lussac et Thénard ont réduit l'acide borique à des températures élevées en présence de fer pour produire du bore. Ils ont également montré le processus inverse, c'est-à-dire où l'acide borique est un produit de l'oxydation du bore.
Identification et isolement
Jöns Jakob Berzelius (1827) a atteint l'identification de Boro en tant qu'élément. En 1892, le chimiste français Henri Moissan a réussi à produire du bore avec une pureté de 98%. Bien que, il est souligné que le boron a été produit uniquement par le chimiste américain Ezekiel Weintraub, en 1909.
Propriétés
Description physique
Poudre amorphe cristalline solide ou brun noir.
Peut vous servir: peroxydes: propriétés, nomenclature, utilisations, exemplesMasse molaire
10 821 g / mol.
Point de fusion
2076 ºC.
Point d'ébullition
3927 ºC.
Densité
-Liquide: 2,08 g / cm3.
-Cristallin et amorphe à 20 ºC: 2,34 g / cm3.
Chaleur de fusion
50,2 kJ / mol.
Chaleur de vaporisation
508 kJ / mol.
Capacité calorique molaire
onze.087 J / (mol · k)
Énergie d'ionisation
-Premier niveau: 800.6 kJ / mol.
-Deuxième niveau: 2.427 kJ / mol.
-Troisième niveau: 3.659,7 kJ / mol.
Électronégativité
2.04 sur l'échelle Pauling.
Radio atomique
21 h (empirique).
Volume atomique
4,16 cm3/ mol.
Conductivité thermique
27,4 w / m.K
Résistivité électrique
~ 106 Ω.M (à 20 ° C).
Les températures élevées Le bore est un bon conducteur électrique, mais à température ambiante, il devient presque un isolant.
Dureté
~ 9,5 sur l'échelle Mohs.
Réactivité
Le bore n'est pas affecté par l'acide chlorhydrique à température d'ébullition. Cependant, il est converti par l'acide nitrique chaud en acide borique (h3Bêle3). Boro se comporte chimiquement comme un non-métal.
Réagit avec tous les halogènes pour donner des trihaluros, hautement réactifs. Ceux-ci ont la formule générale bx3, Où x représente l'halogène.
Il est combiné avec plusieurs éléments pour créer des boruros. Certains d'entre eux font partie des substances d'une plus grande dureté; Par exemple, nitrure de bore (BN). Le bore est combiné avec de l'oxygène pour former un trioxyde de bore.
Structure et configuration électroniques du bore
Liens et unités structurelles en bore
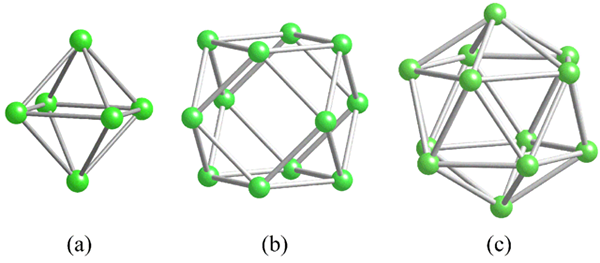 Géométries des unités structurelles communes pour le bore. Source: MaterialScientist [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Géométries des unités structurelles communes pour le bore. Source: MaterialScientist [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] Avant de traiter les structures de bore (cristalline ou amorphe), il est essentiel de garder à l'esprit comment leurs atomes peuvent être liés. Le lien B-B est en essence covalente; Non seulement cela, mais parce que naturellement les atomes de boro ont une carence électronique, ils essaieront de le fournir dans leurs liens d'une manière ou d'une autre.
Dans le bore, il existe un type spécial de liaison covalente: celle de trois centres et deux électrons, 3C2E. Ici, trois atomes de bore partagent deux électrons et définissent un triangle, l'un des nombreux visages trouvés dans leurs polyèdros structurels (image supérieure).
De gauche à droite, nous avons: Octaedro (A, B6), Cuboctaedro (b, b12), Et l'isodiase (c, b12 aussi). Toutes ces unités partagent une fonctionnalité: elles sont pauvres en électrons. Par conséquent, ils doivent lier de manière covalente entre eux; Et le résultat est une fête de liaison surprenante.
Dans chaque triangle de ces polyèdros, le lien 3C2E est présent. Sinon, il ne pourrait pas s'expliquer comment le boron, capable de ne former que trois liaisons covalentes selon la théorie des liens de Valence, peut avoir jusqu'à cinq liens dans ces unités polyédriques.
Les structures de bore consistent ensuite en une disposition et une répétition de ces unités qui finissent par définir un cristal (ou un solide amorphe).
Boro α-Romboédrico
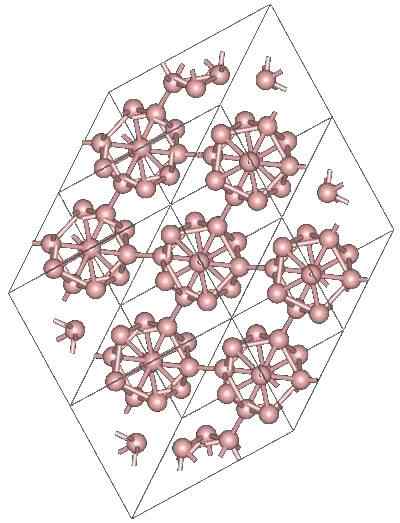 Structure cristalline du bore α-Romboedrico alotrope. Source: MaterialScientist chez English Wikipedia [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Structure cristalline du bore α-Romboedrico alotrope. Source: MaterialScientist chez English Wikipedia [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] Il peut y avoir d'autres unités polyédriques de boro, ainsi qu'un composé uniquement par deux atomes, b2; une "ligne" de bore qui doit être liée à d'autres atomes après sa haute carence électronique.
L'Icosaedro est de loin l'unité préférée du bore; Celui qui se sent mieux. Dans l'image supérieure, par exemple, il est apprécié de la façon dont ces unités B12 Ils entrelacent pour définir le cristal rhomboédrique du bore-α.
Si l'un de ces Icosaedros voulait être isolé, ce serait une tâche compliquée, car leur carence électronique les oblige à définir un cristal où chacun fournit les électrons dont les autres voisins ont besoin.
Bore β-Romboédrico
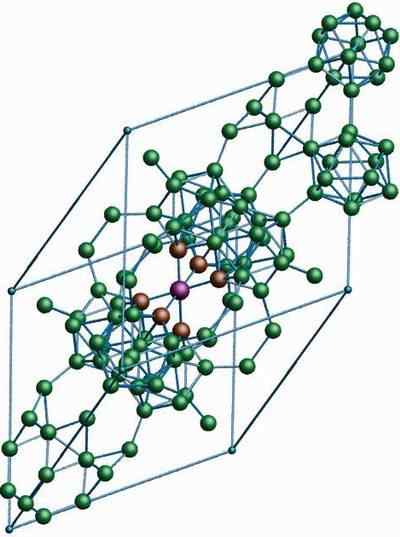 Structure cristalline du bore β-Romboédrico alotrope. Source: MaterialScientist chez English Wikipedia [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Structure cristalline du bore β-Romboédrico alotrope. Source: MaterialScientist chez English Wikipedia [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] Le bore β-Romboédrico alotropique, comme son nom l'indique déjà, a des cristaux de rhomboédica ainsi que du boron-α; Cependant, il diffère dans ses unités structurelles. Il ressemble à un navire extraterrestre fait avec des atomes de bore.
Il peut vous servir: hydroxyde de lithium (LIOH)Si vous pouvez voir attentivement les unités icosaédriques de manière discrète et fusionnée (au centre). Il y a aussi des unités Bdix et des atomes de bore solitaire qui agissent comme un pont pour les unités susmentionnées. De tous, c'est l'alotrope de bore le plus stable.
Boro-γ Gema
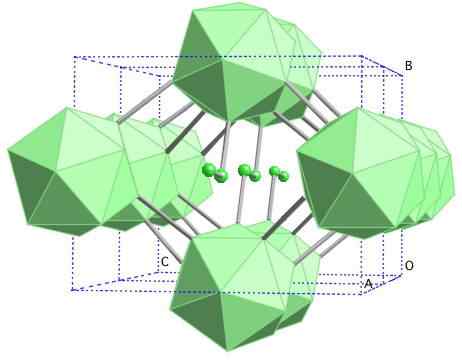 Structure cristalline du bore-γ. Source: MaterialScientist chez English Wikipedia [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Structure cristalline du bore-γ. Source: MaterialScientist chez English Wikipedia [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] Dans cet alotrope de bore, les unités B sont coordonnées2 et B12. Le b2 présente tellement de carence électronique qui enlève en fait les électrons de b12 Et il y a donc un caractère ionique dans ce solide. Autrement dit, non seulement ils sont unis de manière covalente, mais il existe une attraction électrostatique de type [b2-] [B12+]].
Boro-γ cristallise dans une structure de sel Gema, la même que pour NaCl. D'autres alotropes du bore aux pressions élevées (20 GPa) et des températures (1800 ° C) sont obtenus, puis restent stables dans des conditions normales. Sa stabilité factuelle rivalise avec celle du boron β-Romboédrico.
Cube et amorphe
D'autres alotropes du bore sont constitués d'agrégats d'atomes B comme s'ils étaient unis par une liaison métallique, ou comme s'il s'agissait de cristaux ioniques; c'est-à-dire, c'est un bore cube.
Aussi, et surtout, le bore amorphe, dont la disposition des unités B12 C'est aléatoire et désordonné. Il est présenté comme une poudre fine ou vitreuse de couleurs sombres et de brun opaque.
Borofène
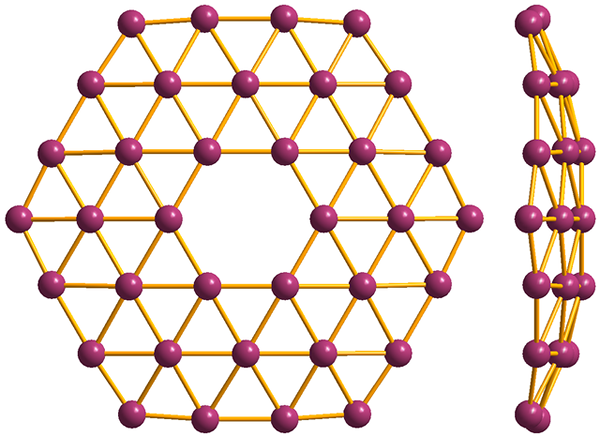 Structure du plus simple du borofène, le B36. Source: MaterialScientist [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Structure du plus simple du borofène, le B36. Source: MaterialScientist [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] Et enfin est le plus nouveau et le plus bizarre de Boro: Borofenos (image supérieure). Il se compose d'une couche de singe d'atomes de bore; Extrêmement mince et analogue au graphène. Notez qu'il conserve les triangles célèbres, caractéristiques de la carence électronique que ses atomes souffrent.
En plus des borofénos, dont le b36 C'est le plus simple et le plus petit, il y a aussi des grappes de Boro. Le borosféène (image ci-dessous) se compose d'une cage sphérique similaire à une boule de quarante atomes de boro, b40; Mais au lieu d'avoir des bords lisses, ils sont brusques et irréguliers:
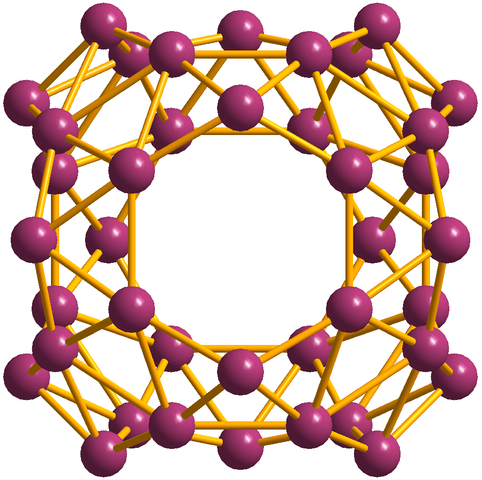 Unité Borosferenos, B40. Source: MaterialScientist [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Unité Borosferenos, B40. Source: MaterialScientist [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] Configuration électronique
La configuration électronique du bore est:
[Il] 2s2 2 P1
Par conséquent, trois électrons de Valence. Il n'a pas cinq autres pour compléter son octeto de Valence, et il peut à peine former trois liens covalents; J'aurais besoin d'un quatrième lien datif pour compléter votre octet. Le bore peut perdre ses trois électrons pour acquérir un état d'oxydation de +3.
Obtention
Le bore est isolé en réduisant l'acide borique avec du magnésium ou de l'aluminium; Méthode similaire à Gay-Lussac et Thénard. Il a la difficulté de la pollution du bore avec les boruros de ces métaux.
Un échantillon de haute pureté peut être obtenu par une réduction gazeuse du trichlorure de bore, ou tribromide, avec de l'hydrogène sur des filaments chauffés électriquement en tant que.
Un bore de haute pureté est préparé par décomposition à des températures élevées de diborano, suivie d'une purification par fusion des processus de zone ou de czocharalski.
Applications
Dans l'industrie
Le bore élémentaire a été utilisé dans le durcissement de l'acier. Dans un alliage avec le fer qui contient entre 0,001 et 0,005% de bore. Il est également utilisé dans l'industrie non ferreux, généralement en tant que désoxydant.
De plus, le boron est utilisé comme boueux dans des alliages à base de cuivre et du cuivre à haute conductance. Dans l'industrie des semi-conducteurs, de petites quantités de boro sont ajoutées en tant qu'agent doping du silicium et de Germanio.
Peut vous servir: isopréno: structure, propriétés, applicationsOxyde de boro (b2SOIT3) est mélangé avec de la silice pour faire un verre résistant à la chaleur (verre borosylique), utilisé dans les ustensiles de cuisine et certains équipements de laboratoire.
Carbure de boro (b4C) Il s'agit d'une substance extrêmement dure qui est utilisée comme agent abrasif et de renforcement dans les matériaux composites. Boruro en aluminium (alb12) Il est utilisé comme substitut de poussière de diamant pour les givrés et polis.
Le bore est utilisé dans les alliages, par exemple dans des aimants de terres rares, alliage avec du fer et du néodyme. Les aimants formés sont utilisés dans la fabrication de microphones, de commutateurs magnétiques, d'écouteurs et d'accélérateurs de particules.
En médecine
La capacité de l'isotope Boro-10 (dixB) Pour attraper des neutrons, l'émission de radiations de type α a été utilisée pour le traitement des tumeurs cérébrales dans une technique connue sous le nom de thérapie de capture de neutrons de bore (BNCT).
Il dixB sous forme de composés se cumule dans la tumeur cancéreuse. Par la suite, la zone tumorale avec des neutrons est rayonnée. Ceux-ci interagissent avec dixB, ce qui cause l'émission de particules α. Ces particules ont un effet biologique relatif élevé et en raison de leur grande taille, ils ont peu de portée.
Ainsi, l'action destructrice des particules α est confinée dans les cellules tumorales, effectuant leur destruction. Le BNCT est également utilisé dans le traitement des tumeurs du cou, du foie, de la vessie et de la prostate.
Action biologique
Une petite quantité d'acide borique ou de bore en forme de borégration est nécessaire pour la croissance de nombreuses plantes. Une carence en bore se manifeste dans la croissance déformée des plantes; le «cœur brun» des légumes; et la "pourriture sèche" de la betterave à sucre.
Le bore peut être nécessaire en petites quantités pour maintenir la santé des os. Il existe des études qui indiquent que le manque de bore serait impliqué dans la génération d'arthrite. Il interviendrait également dans les fonctions du cerveau telles que la mémoire et la coordination-homme-homme.
Certains experts soulignent que 1,5 à 3 mg de bore devraient être inclus dans le régime alimentaire quotidien.
Risques et prudence
Le bore, l'oxyde de bore, l'acide borique et les boratos, sont considérés comme non toxiques. Le LD50 pour les animaux est de 6 g de bore / kg de poids corporel, tandis que les substances avec un LD50 supérieur à 2 g / kg de poids corporel sont considérées comme non toxiques.
D'un autre côté, la consommation de plus de 0,5 mg / bore pendant 50 jours provoque des problèmes digestifs mineurs, suggérant une toxicité. Certains rapports soulignent qu'un excès de consommation de bore peut affecter le fonctionnement de l'estomac, du foie, des reins et du cerveau.
De même, des effets irritants à court terme ont été indiqués dans le nasopharynx, les voies respiratoires supérieures et les yeux pour l'exposition au bore.
Les rapports sur la toxicité du bore sont rares et dans de nombreux cas, la toxicité est présentée à des doses très élevées, plus que la population générale est exposée.
La recommandation est de surveiller la teneur en bore des aliments, en particulier les légumes et les fruits. Les agences de santé gouvernementales doivent surveiller que la concentration en bore d'eau ne dépasse pas les limites autorisées.
Les travailleurs exposés à la poussière contenant du bore devraient porter des masques qui protègent les voies respiratoires, les gants et les bottes spéciales.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Allotropes de bore. Récupéré de: dans.Wikipédia.org
- Prof. Robert J. Lancashire. (2014). Conférence 5B. Structure des éléments (non-métaux, b, c). Le Département de chimie, Université des Antilles, Mona Campus, Kingston 7, Jamaïque. Récupéré de: Chem.Uwimona.Édu.Jm
- Manisha Lalloo. (28 janvier 2009). Structure de bore ultra-pure découverte. Monde de chimie. Récupéré de: Chemistryworld.com
- Bell Terence. (16 décembre 2018). Un profil du boron métallique. Récupéré de: the balance.com
- Les éditeurs d'Enyclopaedia Britannica. (2019). BORE. Récupéré de: Britannica.com
- Agence pour le registre des substances toxiques et des maladies. (2010). TOXFAQS ™ sur le boron. [PDF]. Récupéré de: ATSDR.CDC.Gouvernement
- Helmestine, Anne Marie, Ph.D. (6 février 2019). Propriétés chimiques et physiques du bore. Récupéré de: Thoughtco.com
- « Propriétés du calcium, structure, obtenant, utilisations
- Calcination de processus, types, applications »

