Anhydrides

- 4651
- 704
- Lucas Schneider
Que sont les anhydrides?
Les Anhydrides Ce sont des composés chimiques qui proviennent de l'union de deux molécules par libération de l'eau. Ainsi, il pourrait être considéré comme une déshydratation des substances initiales; Bien que ce ne soit pas précisément vrai.
Dans la chimie organique et inorganique, ils sont mentionnés, et dans les deux branches, leur compréhension diffère à un degré appréciable. Par exemple, dans la chimie inorganique, sont considérés comme des oxydes de base et des oxydes acides tels que les anhydries de leurs hydroxydes et acides respectivement, car les premiers réagissent avec l'eau pour former le second.
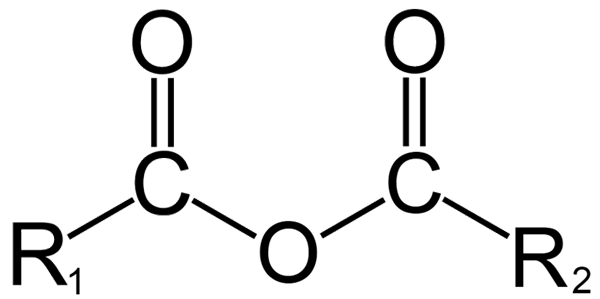 Structure générale des anhydrides. Source: dremmetbrownie [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)], de Wikimedia Commons
Structure générale des anhydrides. Source: dremmetbrownie [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)], de Wikimedia Commons Ici, une confusion entre les termes «anhydre» et «anhydrido» peut être générée. Généralement, l'anhydre fait référence à un composé auquel il s'est déshydraté sans changements dans sa nature chimique (il n'y a pas de réaction); Tandis qu'avec un anhydride, il y a un changement chimique, reflété dans la structure moléculaire.
Si les hydroxydes et acides (ou anhydrides) correspondants sont comparés, il sera observé qu'il y a eu une réaction. D'un autre côté, certains oxydes ou sels peuvent être hydratés, perdre de l'eau et continuer à être les mêmes composés; Mais, sans eau, c'est-à-dire des anhydros.
En chimie organique, en revanche, ce qui est compris par l'anhydride est la définition initiale. Par exemple, l'un des anhydrides les plus connus est ceux dérivés d'acides carboxyliques (image supérieure). Ceux-ci se composent de l'union de deux groupes acyl (-RCO) par un atome d'oxygène.
Dans sa structure générale, R est indiqué1 Pour un groupe acyle, et r2 Pour le deuxième groupe ACILO. Parce que r1 et r2 Ils sont différents, proviennent de différents acides carboxyliques, puis c'est un anhydride d'acide asymétrique. Lorsque les deux substituants R (qu'ils soient aromatiques) sont les mêmes, il y a des discussions dans ce cas d'un anhydride d'acide symétrique.
Au moment de lier deux acides carboxyliques pour former de l'anhydride, l'eau peut se former ou non, ainsi que d'autres composés. Tout dépendra de la structure de ces acides.
Propriétés des anhydrides
Les propriétés des anhydrides dépendront de laquelle fait référence. Presque tout le monde a en commun qu'ils réagissent avec l'eau. Cependant, pour les anhydrides de base So-appels en inorganique, plusieurs d'entre eux sont même insolubles dans l'eau (MGO), donc cette déclaration se concentrera sur les anhydrides des acides carboxyliques.
Les points de fusion et d'ébullition tombent sur la structure moléculaire et les interactions intermoléculaires pour (RCO)2Ou, c'est la formule chimique générale de ces composés organiques.
Si la masse moléculaire de (RCO)2Ou il est bas, c'est probablement un liquide incolore à température ambiante et à la pression. Par exemple, anhydride acétique (ou ehydridge3CO)2Ou, c'est une importance industrielle liquide et la plus importante, sa production étant très vaste.
La réaction entre l'anhydride acétique et l'eau est représentée par l'équation chimique suivante:
(Ch3CO)2Ou + h2O => 2ch3COOH
Notez que lorsque la molécule d'eau est ajoutée, deux molécules d'acide acétique sont libérées. La réaction inverse ne peut cependant pas se produire pour l'acide acétique:
Peut vous servir: équilibre de vapeur liquide2ch3COOH => (CHO3CO)2Ou + h2Ou (n'arrive pas)
Il est nécessaire de recourir à une autre voie synthétique. Les acides dicarboxyliques, en revanche, peuvent le faire en chauffant; Mais il sera expliqué dans la section suivante.
Réactions chimiques
Hydrolyse
L'une des réactions les plus simples des anhydrides est leur hydrolyse, qui vient d'être montrée pour l'anhydride acétique. En plus de cet exemple, il y a celui de l'anhydride d'acide sulfurique:
H2S2SOIT7 + H2Ou 2h2Swin4
Ici, vous avez un anhydride d'acide inorganique. Notez que pour H2S2SOIT7 (également appelé acide disulfurique), la réaction est réversible, donc chauffant H2Swin4 Le concentré entraîne la formation de son anhydride. Si, en revanche, c'est une solution diluée de H2Swin4, Il est sorti ainsi3, Anhydride sulfurique.
Estérification
Les anhydrides d'acide réagissent avec les alcools, avec la pyridine au milieu, pour donner naissance à un ester et à un acide carboxylique. Par exemple, la réaction entre l'anhydride acétique et l'éthanol est considérée:
(Ch3CO)2Ou + ch3Ch2Oh => cho3CO2Ch2Ch3 + Ch3COOH
Formant ainsi l'ester éthylique d'éthane, ch3CO2Ch2Ch3, et l'acide d'éthane (acide acétique).
En pratique, ce qui se passe, c'est le remplacement de l'hydrogène du groupe hydroxyle, par un groupe Aquilus:
R1-Oh => r1-Ocor2
Dans le cas de (ch3CO)2Ou, votre groupe acilo est le -coch3. Par conséquent, on dit que le groupe OH subit une acilation. Cependant, l'acilation et l'estérification ne sont pas des concepts interchangeables; L'acillation peut se produire directement dans un anneau aromatique, connu sous le nom de nom d'accilation Friedel-Crafts.
Ainsi, les alcools en présence d'anhydrides acides sont estérifiés par acilation.
D'un autre côté, un seul des deux groupes d'acide réagit avec l'alcool, l'autre reste avec de l'hydrogène formant un acide carboxylique; que dans le cas de (Cho3CO)2Ou, c'est l'acide éthanoïque.
Amidation
Les anhydrides acides réagissent avec l'ammoniac ou les amines (primaire et secondaire), pour donner naissance aux amides. La réaction est très similaire à l'estérification nouvellement décrite, mais le ROH est remplacé par une amine; Par exemple, une Amina secondaire, R2NH.
Encore une fois, la réaction entre (ch3CO)2Ou et diéthylamine, et2NH:
(Ch3CO)2O + 2et2Nh => ch3Suite2 + Ch3Roucouler- +NH2ET2
Et le diéthilacétamide se forment, Cho3Suite2, et un sel d'ammonium carboxylé, CHO3Roucouler- +NH2ET2.
Bien que l'équation puisse sembler un peu difficile à comprendre, il suffit d'observer comment le groupe -coch3 remplacer le H d'un ET2NH pour former l'amida:
ET2Nh => et2MNCOCH3
Plus qu'une amidation, la réaction est toujours une acilation. Tout est résumé dans ce mot; Cette fois, l'Amina souffre d'acilation et non d'alcool.
Comment sont les anhydrides?
Les anhydrides inorganiques sont formés en réagissant l'élément avec de l'oxygène. Ainsi, si l'élément est métallique, un oxyde métallique de base est formé; Et s'il n'est pas-métallique, un anhydride d'oxyde ou d'acide non métallique est formé.
Il peut vous servir: Clausius-Clapeyron Equation: à quoi sert, des exemples, des exercicesPour les anhydrides organiques, la réaction en est une autre. Deux acides carboxyliques ne peuvent pas se joindre directement pour libérer de l'eau et former de l'acide d'anhydride; La participation d'un composé qui n'a pas encore été mentionné: le chlorure d'acyle, RCOCL est nécessaire.
L'acide carboxylique réagit avec le chlorure d'acide, produisant l'anhydride respectif et le chlorure d'hydrogène:
R1Cocl + R2COOH => (R1Co) ou (cor2) + HCl
Ch3Cocl + ch3COOH => (CHO3CO)2O + HCL
Un ch3 vient du groupe acétyle, Cho3Co-, et l'autre est déjà présent dans l'acide acétique. Le choix d'un chlorure d'acide spécifique, ainsi que de l'acide carboxylique, peut donner lieu à la synthèse d'un anhydride d'acide symétrique ou asymétrique.
Anhydrides cycliques
Contrairement aux autres acides carboxyliques qui nécessitent du chlorure d'acide, les acides dicarboxyliques peuvent se condenser dans leur anhydride correspondant. Pour ce faire, il est nécessaire de les chauffer pour promouvoir la libération de H2SOIT. Par exemple, la formation d'anhydride phtalique est montrée à partir de l'acide photographique.
 Formation de l'anhydride fthalique. Source: Jü [domaine public], de Wikimedia Commons
Formation de l'anhydride fthalique. Source: Jü [domaine public], de Wikimedia Commons Notez comment l'anneau pentagonal est terminé, et l'oxygène qui rejoint les deux groupes C = O en fait partie; C'est un anhydride cyclique. On peut également voir que l'anhydride phtalique est un anhydride symétrique, car tant de R1 comme r2 Ils sont identiques: un anneau aromatique.
Tous les acides dicarboxyliques ne peuvent pas former leur anhydride, car lorsque leurs groupes COOH sont très séparés, ils sont obligés de terminer des anneaux de plus en plus grands. Le plus grand anneau qui peut être formé est un hexagonal, plus grand que la réaction ne se déroule pas.
Nomenclature
Comment les anhydrides sont-ils nommés? Laissant de côté les problèmes inorganiques, pertinents pour les problèmes d'oxyde, les noms des anhydrides organiques expliquent jusqu'à présent dépendre de l'identité de r1 et r2; c'est-à-dire de ses groupes acyle.
Si les deux R sont les mêmes, il suffit de remplacer le mot «acide» par «anhydride» dans le nom respectif de l'acide carboxylique. Et si, au contraire, les deux R sont différents, ils sont nommés dans l'ordre alphabétique. Par conséquent, pour savoir comment l'appeler, vous devez d'abord voir s'il s'agit d'un anhydride symétrique ou asymétrique.
Le ch3CO)2Ou c'est symétrique, puisque r1= R2 = Ch3. Il dérive de l'acide acétique ou éthanoïque, donc son nom est, suivant l'explication précédente: anhydride acétique ou éthanoïque. La même chose se produit avec l'anhydride fthalique qui vient d'être mentionné.
Supposons que vous ayez l'anhydride suivant:
Ch3Co (o) coch2Ch2Ch2Ch2Ch2Ch3
Le groupe acétyle de gauche provient de l'acide acétique, et celui à droite, de l'acide heptanoïque. Pour nommer cet anhydride, vous devez nommer ses groupes R par ordre alphabétique. Donc, son nom est: anhydride acétique heptanoïque.
Applications
Les anhydrides inorganiques ont des applications infinies, de la synthèse et de la formulation de matériaux, de céramiques, de catalyseurs, de ciments, d'électrodes, d'engrais, etc., jusqu'à un revêtement de la croûte terrestre avec ses milliers de minéraux de fer et d'aluminium, et le dioxyde de carbone exhalé par des organismes vivants.
Peut vous servir: décantation: concept, exemples et typesIls représentent la source de départ, le point où de nombreux composés utilisés dans la synthèse inorganique dérivent. L'un des anhydrides les plus importants est celui de Carbonic, CO2. Il est, avec l'eau, essentiel pour la photosynthèse. Et à un niveau industriel, le SO3 Il est essentiel car l'acide sulfurique défendeur en est obtenu.
Peut-être, l'anhydride avec plus d'applications et pour avoir (tant qu'il y a de la vie) est celui de l'acide phosphorique: l'adénosine tryposphate, mieux connue sous le nom d'ATP, présente dans l'ADN et la «monnaie énergétique» du métabolisme.
Anhydrides organiques
Les anhydrides acides réagissent par acylation, soit à un alcool, formant un ester, une amine, donnant naissance à un amida ou à un anneau aromatique.
Il existe des millions de chacun de ces composés et des centaines de milliers d'options d'acide carboxylique pour préparer un anhydride; Par conséquent, les possibilités synthétiques se développent considérablement.
Ainsi, l'une des principales applications consiste à incorporer un groupe acide dans un composé, en remplacement de l'un des atomes ou groupes de sa structure.
Chaque dioxyde séparément a ses propres applications, mais en termes généraux, ils réagissent tous de la même manière. Pour cette raison, ces types de composés sont utilisés pour modifier les structures polymères, créant de nouveaux polymères; c'est-à-dire des copolymères, des résines, des revêtements, etc.
Par exemple, l'anhydride acétique est utilisé pour acétiller tous les groupes de cellulose OH (image inférieure). Avec cela, chaque H du OH est remplacé par un groupe acétyle, Coch3.
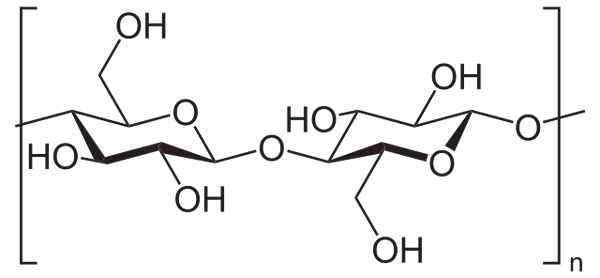 Cellulose. Source: Neurotoger [domaine public], de Wikimedia Commons
Cellulose. Source: Neurotoger [domaine public], de Wikimedia Commons De cette façon, le polymère d'acétate de cellulose est obtenu. La même réaction peut être esquissée avec d'autres structures polymères avec des groupes NH2, Également sensible à l'acilation.
Ces réactions d'acilation sont également utiles pour la synthèse des médicaments, comme l'aspirine (acide acétylsalicylique).
Exemples
On montre qu'ils finissent d'autres exemples d'anhydries organiques. Bien qu'ils ne les mentionnent pas, les atomes d'oxygène peuvent être remplacés par du soufre, donnant des anhydrides sulfurisés, voire du phosphore.
-C6H5Co (o) cuisiner6H5: Anhydride benzoïque. Groupe C6H5 représente un anneau de benzène. Son hydrolyse produit deux acides benzoïques.
-HCO (O) COH: anhydride formique. Son hydrolyse produit deux acides formiques.
- C6H5Co (o) coch2Ch3: Anhydride benzoïque propanoïque. Son hydrolyse produit des acides benzoïques et propaniques.
-C6HonzeCo (o) cuisiner6Honze: Cyclohexanocroboxylicanight anhydrid. Contrairement aux anneaux aromatiques, ceux-ci sont saturés, sans doubles liens.
-Ch3Ch2Ch2Co (o) coch2Ch3: Anhydride butanique propanoïque.
Anhydride succinique
 Anhydride succinique. Source: Ninjatacoshell [domaine public], de Wikimedia Commons
Anhydride succinique. Source: Ninjatacoshell [domaine public], de Wikimedia Commons Ici, vous avez un autre cyclique, dérivé de l'acide succinique, un acide dicarboxylique. Remarque Comme les trois atomes d'oxygène trahissent la nature chimique de ce type de composé.
L'anhydride Maleico est très similaire à celui du succinique, avec la différence qu'il y a une double liaison entre les carbones qui forment la base du pentagone.
Anhydride glutaire
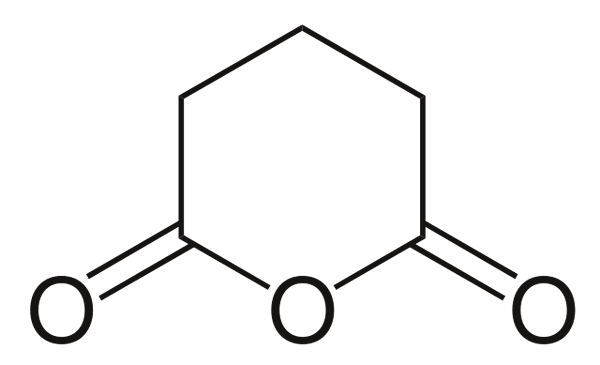 Anhydride glutaire. Source: Choij [domaine public], de Wikimedia Commons
Anhydride glutaire. Source: Choij [domaine public], de Wikimedia Commons Et enfin l'anhydride de l'acide glutarique est montré. Cela distingue structurellement tous les autres en composé d'une bague hexagonale. Encore une fois, les trois atomes d'oxygène se distinguent dans la structure.
D'autres anhydrides plus complexes peuvent toujours être mis en évidence par les trois atomes d'oxygène très proches les uns des autres.
Les références
- Anhydride. Enclyclopaedia Britannica. Récupéré de: Britannica.com
- Définition de l'anhydride acide en chimie. Récupéré de: Thoughtco.com

