Alotropes de carbone
- 3312
- 620
- Raphaël Meyer
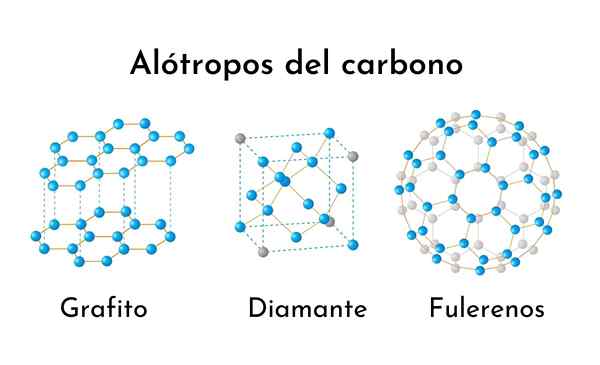
 Trois des alotropes de carbone les plus courants
Trois des alotropes de carbone les plus courants Que sont les alotropes de carbone?
Le mot alotrope se réfère aux différentes formes moléculaires dans lesquelles un élément chimique peut être présenté. Par conséquent, les alotropes en carbone sont tous des formes, naturelles ou non, car l'élément de carbone pur peut être présenté.
Malgré la même composition exactement, les alotropes peuvent avoir des propriétés complètement différentes.
Ceci est particulièrement connu dans le cas des alotropes de carbone. Comme nous le verrons plus tard, l'un des alotropes, le diamant, forment des cristaux parfaitement transparents et incroyablement durs, tandis que d'autres sont des substances douces et cassantes.
Ensuite, tous les alotrops en carbone sont décrits jusqu'à présent, ainsi que leurs propriétés les plus remarquables et leurs applications:
diamant
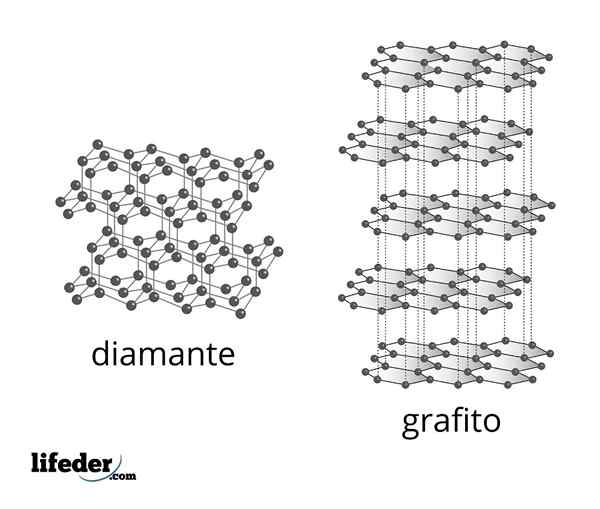 Structure microscopique du diamant et du graphite
Structure microscopique du diamant et du graphite Le diamant est la forme de carbone la plus stable et est l'un des deux alotropes les plus connus de cet élément. Il est composé d'atomes de carbone tétraédrique avec hybridation SP3 lié au moyen de liaisons covalentes C-C simples dans un réseau covalent tridimensionnel.
Cet alotrope en carbone est naturellement ou peut être fabriqué industriellement à partir de graphite avec des pressions élevées.
Propriétés
- Il se compose d'un solide cristallin transparent et incolore qui peut être poli à une haute luminosité.
- C'est le minéral le plus difficile connu de l'homme. Cela signifie qu'un diamant est capable de gratter la surface de tout autre matériau et ne peut être rayé qu'avec un autre diamant.
- C'est l'un des éléments naturels les plus chers du monde.
- C'est le meilleur conducteur thermique connu, avec une conductivité thermique entre 1300 et 2300 W / M.K.
- Ne conduit pas d'électricité.
- Il a un coefficient de dilatation thermique très faible.
- Il a un coefficient de frottement très faible.
Applications
- Son utilisation quotidienne la plus connue est dans les bijoux.
- En raison de sa dureté, c'est un excellent matériau abrasif, il est donc ajouté à la surface des instruments de coupe et de polissage des métaux, des roches, etc.
- En raison de ses propriétés thermiques, il est utilisé dans la fabrication de dissipateurs de chaleur.
- Il est utilisé dans la fabrication de micro-roulements à faible frottement.
Graphite
C'est un autre des alotropes de carbone les plus connus. C'est un matériau très commun qui a une structure formée par des feuilles d'atomes de carbone empilées sur l'autre.
Tous les atomes de carbone en graphite ont une hybridation SP2, Ils ont donc une structure trigonale plate. Chaque carbone est lié à trois autres carbones voisins formant des hexagones similaires au benzène, avec un système d'électrons Pi démodé à la surface de chaque feuille, ce qui fait de la conduite de l'électricité en graphite.
Propriétés
- C'est un matériau noir solide à température ambiante.
- C'est du carburant, vous pouvez donc brûler en présence d'oxygène.
- Le graphite est un bon conducteur électrique.
- Il a un point de fusion élevé.
- C'est un matériau doux qui donne l'impression d'être glissant.
- Il a un coefficient de frottement faible.
- C'est un bon conducteur thermique.
Applications
- Il est fréquemment utilisé dans la fabrication de crayons pour écrire ou pour dessiner.
- Il est fréquemment utilisé comme lubrifiant sec.
- En raison de sa conductivité électrique et de sa faible réactivité chimique, il est fréquemment utilisé dans les contacts électriques dans différents dispositifs électroniques.
- Il est utilisé dans les électrodes pour l'analyse chimique.
Graphène
 Structure de graphène
Structure de graphène Le graphène n'est rien de plus qu'une feuille de graphite isolé. Il est défini comme un cristal à deux dimensions, et il est obtenu en séparant les couches de graphite avec du ruban adhésif. Le graphène a des propriétés uniques qui le distinguent du graphite, malgré une très ressemblance dans la structure.
Peut vous servir: loi de bière-lambbePropriétés
- Haute conductivité électrique et thermique.
- C'est un matériau élastique et flexible, mais en même temps avec une dureté et une résistance élevées.
- Pour avoir une seule épaisseur d'atome de carbone, c'est un matériau complètement transparent.
- Il peut générer de l'électricité par exposition au soleil.
Applications
- Écrans flexibles.
- Circuits électroniques flexibles.
- Revêtements anticorrosives.
- Panneaux solaires très efficaces.
- Systèmes de séquençage d'ADN.
- Biocapteurs de haute précision.
Les gars ou le nanocarbone
Les gars sont des structures moléculaires fermées formées uniquement par des atomes de carbone dans lesquels des arrangements sont présentés sous forme d'anneaux de 4 à 7 membres.
Selon leur taille et leur forme, plusieurs types de gars se distinguent généralement:
Buckminsterfulenerane (c60)
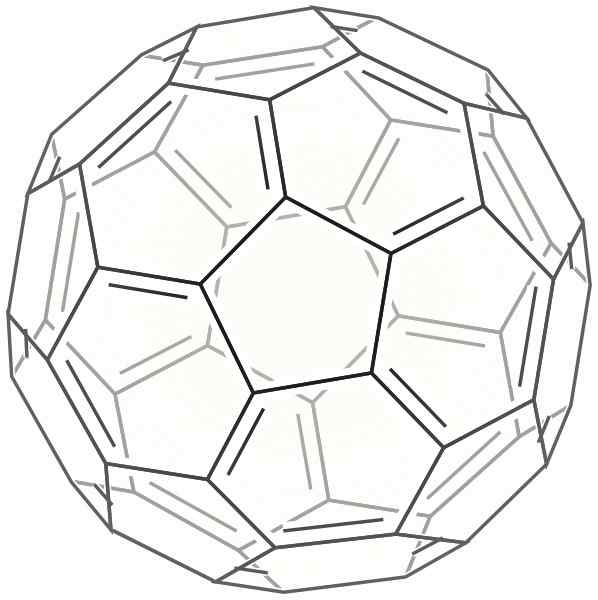 Squelette 2D Buckminsterfulera
Squelette 2D Buckminsterfulera Cela a la forme d'une sphère très similaire à un ballon de football. Il est aussi appelé Bucky Ball.
Propriétés
- Haute conductivité électrique et thermique
- Résistance élevée à la tension.
- Ils forment un matériau très ductile.
- Ils sont relativement inertes aux réactions chimiques.
Applications
- Antiviraux
- Antioxydants
- Systèmes d'administration de médicaments
Nanotubes de carbone
 Structure d'un nanotubus de carbone dans lequel tous les atomes de carbone sont unis ensemble au moyen de liaisons covalentes non polaires
Structure d'un nanotubus de carbone dans lequel tous les atomes de carbone sont unis ensemble au moyen de liaisons covalentes non polaires Ceux-ci forment la base et le début de la nanotechnologie. Ce sont des traits longs à la forme tubulaire et sont l'un des matériaux les plus étudiés aujourd'hui par les innombrables applications de leurs propriétés uniques.
Propriétés
Ils ont les mêmes propriétés de base des boules de bucky, mais lorsqu'elles sont allongées, ce sont de meilleurs conducteurs d'électricité dans la direction axiale.
Applications
- Dans la fabrication de matériaux nanocomposés avec des propriétés mécaniques, thermiques et électriques uniques.
- Systèmes d'électronique moléculaire.
- Biocapteurs à haute sensibilité.
- Systèmes de stockage d'énergie.
Graphénylène
Cet alotrope a une structure de verre à deux dimensions très similaire au graphène, mais formée par des unités biphénilene avec des anneaux de quatre membres entrecoupés entre les anneaux de six, au lieu de ne contenir que des arrangements hexagonaux.
Graphite aa '
Ceci est une forme de carbone découverte en 2008. C'est un type spécial de graphite qui ne diffère que dans la façon dont les feuilles de graphite sont empilées sur l'autre. Il s'agit d'une forme de graphite métastable qui peut expliquer la formation et les propriétés de certaines nanotubes de carbone de plusieurs couches.
Graphénylène
Graphénylène est un nouveau carbonotrope récemment découvert. Ils se composent d'une forme de diamant à deux dimensions obtenue en compressant du graphite à des pressions très élevées. Cela fait lier les feuilles de graphite les uns aux autres, formant un diamant de seulement quelques atomes de carbone épais.
Carbone amorphe
Il se compose généralement d'un mélange de différentes formes de carbone dans différentes proportions. Les nanotubes peuvent contenir ou d'autres types de gars, de graphite, etc. Il se trouve dans des échantillons naturels tels que le minéral ou le charbon de bois causé par la pyrolyse du bois.
Il est principalement utilisé comme carburant dans le chauffage, la production d'énergie ou la cuisson des aliments.
Carbone vitreux
C'est une forme de carbone obtenue en chauffant certains précurseurs organiques à des températures élevées. C'est un matériau très résistant à des températures élevées et une attaque chimique par l'acide et l'oxygène. Il est également imperméable aux gaz.
- « 80 phrases scientifiques des scientifiques célèbres
- 100 phrases fatiguées sur la vie, l'amour et le bonheur »

