Concept de loyer, radicaux plus communs, structure
- 1722
- 65
- Adam Mercier
UN je loue C'est un groupe ou un substituant qui dérive d'un alcane en éliminant l'un de ses hydrogènes. Il est donc composé de carbone et d'hydrogène, et sa formule générale est CnH2n + 1, au lieu de cnH2n + 2 Pour tous les alcanes non cycliques, c'est-à-dire des chaînes linéaires ou ramifiées.
Le loyer, en tant que groupe, est symbolisé par la lettre R. Ainsi, la structure moléculaire de nombreux composés organiques peut être généralisée avec l'introduction de r. En eux, R n'est qu'une partie de la molécule, liée à son squelette ou à un groupe fonctionnel réactif.
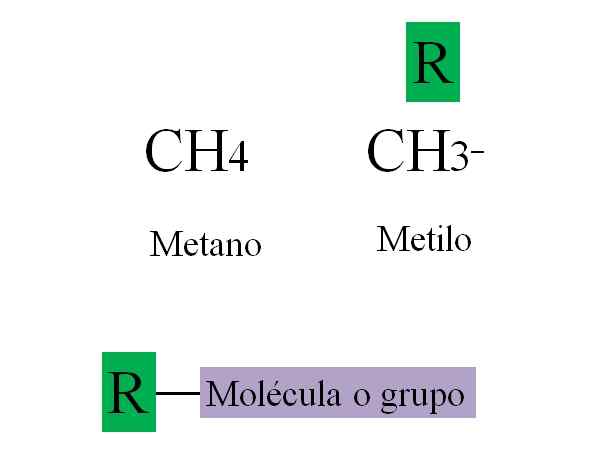 Groupe de loyer. Source: Gabriel Bolívar.
Groupe de loyer. Source: Gabriel Bolívar. L'image supérieure illustre ce qui précède. Metano, ch4, C'est un alcane, et lorsqu'il perd l'un de ses hydrogènes, reliant une molécule ou un groupe, il se transforme en méthyle, ch3-. Le méthyle n'est pas un composé: il n'existe pas comme une molécule libre; À moins que ce ne soit le radical méthyle, CHO3·, Qui est très réactif.
Le loyer, symbolisé par r, forme une liaison covalente avec le reste d'une molécule. Ainsi, les composés alquiliques sont représentés comme RG, où G est un groupe qui englobe la molécule entière. Par exemple, les alcools ont une formule ROH, donc ce sont des composés alkyle.
[TOC]
Nomenclature
La nomenclature du loyer n'a rien à voir avec le revenu d'une propriété. Cela vient de la même nomenclature de l'alcane à partir de laquelle il dérive. Dans l'image ci-dessus, par exemple, le méthane se transforme en groupe méthyle. Ainsi, il suffit de remplacer la résiliation -année, du nom de l'alcane, par la résiliation -ILO.
Un autre exemple a de l'éthane, Cho3Ch3. Lors de la perte d'un de son hydrogène et lié à une molécule ou un groupe, il est transformé en groupe éthylique, ch3Ch2-.
Peut vous servir: Type de lien CO2De la même manière, il se produit avec tous les autres alcanes, même ceux qui se composent de chaînes cycliques telles que le cyclohexan, qui est transformée en cyclohexyle.
Radicaux plus communs
Les radicaux alcynd sont les "pièces lâches et réactives" qui sont obtenues lorsque R est séparé d'une molécule. Leurs abondances sont proportionnelles à celles des groupes loués à partir desquels ils dérivent. Par exemple, le groupe Metilo, Cho3- Et le méthyl radical, Cho3· Ils sont relativement les mêmes que communs.
En général, les radicaux ou les groupes de location provenant d'alcanes contenant moins de cinq atomes de carbone dans leur squelette, sont les plus courants. C'est-à-dire au-dessus du pentano et de tous ses isomères, ces radicaux deviennent plus difficiles à trouver.
Parce que? Il y a deux raisons. La première est que les molécules d'hydrocarbures, dans des conditions énergétiques élevées, ont tendance à subir des ruptures de liaison, de sorte que leurs tailles et masses moléculaires sont réduites.
Et le second est que dans la nature, il y a des "soupes d'isomères", qui sont très difficiles à purifier par distillation en raison de la petite différence entre leurs points d'ébullition.
C'est ainsi que les alkygles les plus abondants et leurs radicaux sont ceux de la chaîne courte, avec un certain nombre d'atomes de carbone inférieurs à six. Des exemples de ces Alks sont: ch3-, Ch3Ch2-, Ch3Ch2Ch2-, Ch3Ch2Ch2Ch2-, Et ses isomères possibles.
Structure
Jusqu'à présent, les Alks adressés ont des structures de chaîne linéaires. Ses structures, comme prévu, sont les mêmes que celles des alcanes de ceux qui continuent.
Les lefes linéaires entraîneront des groupes alkimaux linéaires. Les sommets ramifiés, en revanche, généreront des alcales ramifiées. La même chose se produit avec les alcanes cycliques.
Peut vous servir: iodométrie: fondations, réactions, procédure générale, utilisationsCependant, les alcanes linéaires peuvent également provoquer des alcales apparemment ramifiées, selon laquelle de ses atomes de carbone perd de l'hydrogène. Considérez l'exemple du propane:
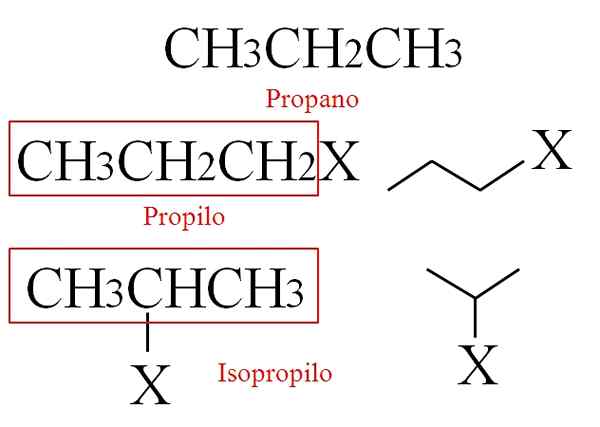
 Structure du propane et ses groupes d'alche dérivés. Source: Gabriel Bolívar.
Structure du propane et ses groupes d'alche dérivés. Source: Gabriel Bolívar. Si vous perdez un hydrogène de l'un de ses carbones principaux, c'est-à-dire, à partir de ceux de ses extrémités, le groupe propyl est obtenu, ch3Ch2Ch2-.
En attendant, si l'hydrogène le perd de son carbone secondaire ou central, le groupe isopropylique est obtenu (CH3)2Ch-. Dans l'image, deux composés Rx sont affichés, R étant le propyl ou l'isopropile.
Propriétés
Les groupes de location ne réagissent généralement pas parce que leurs liens C-C ou C-H ne sont pas faciles à casser. Quelle que soit leur structure moléculaire, ils partagent tous une propriété commune: l'hydrophobicité. C'est-à-dire qu'ils ne montrent pas d'affinité pour l'eau ou aucun solvant polaire. Mais ils le font pour les graisses.
Lorsque le groupe de location est très important, ou lorsqu'il y en a beaucoup dans une molécule, son hydrophobicité augmente. C'est la même chose pour dire que sa lipophilicité augmente (amour pour les graisses). Ainsi, plus une molécule est «louée», plus elle aura une affinité pour les graisses, et plus difficile, il sera difficile de l'enlever avec de l'eau.
Exemples de composés alkyles
Le terme «composés alkyle» est extrêmement ambiguë en termes de chimie organique. Le groupe ou la molécule à laquelle le groupe Rento R est toujours prioritaire est toujours prioritaire. Et ce sont ces groupes ou molécules qui définissent les familles des composés organiques.
Cependant, lorsque ces groupes sont plus fréquents dans la chimie inorganique, comme pour les halogènes et les sulfates, une certaine importance est accordée à la composante alquyle. Quelques exemples seront mentionnés pour clarifier ce point.
Peut vous servir: hydrogène: histoire, structure, propriétés et utilisationsHacks de loyer
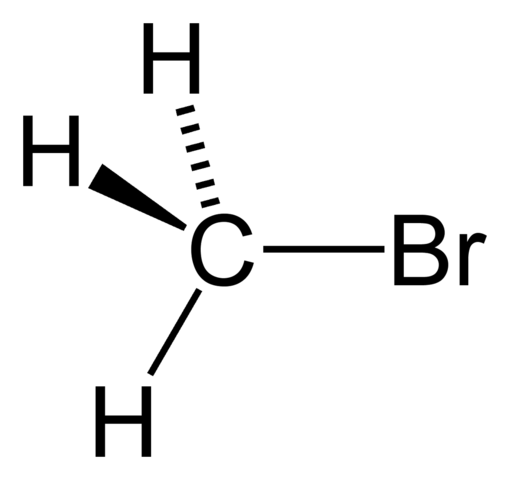 Bromure de méthyle
Bromure de méthyle Les haluros de loyer ont une formule Rx générale, où X est un atome halogène (F, Cl, Br et I), et R tout groupe de groupe ou d'alkyle. Par exemple, Cho3BR est le bromure de méthyle.
Louer des sulfates
 Sulfate de dimétil
Sulfate de dimétil Les sulfates de location ont une formule générale Roso3R ', où r et r' sont deux groupes alcaux qui peuvent être identiques ou différents. Ainsi, nous avons du dimétyl sulfate, CHO3OURS3Ch3 ou moi2Swin4.
Loyer des borates
Les borats de loyer ont une formule générale (RO3) B. Par exemple, le (Cho3Ch2SOIT)3B o (Eto)3B est appelé éthyle borate.
Triaquilboros
De même, nous avons les triaquilboros, dont la formule générale est R3B. Par exemple, le (Cho3)3B o moi3B est appelé trimethylborano (TMB).
Alcools
Les alcools sont également des composés alquiliques, et leur formule générale est ROH. Cependant, la présence unique du groupe OH perd de l'importance pour les groupes loués. Les alcools ne sont pas appelés «hydroxydes d'alkyle», car le loyer en tant que tel n'est pas les parties les plus fondamentales de leurs molécules, mais l'OH.
D'un autre côté, dans les exemples précédents, l'accent est mis sur la présence des groupes loués R; Parce que, en compte, les halogènes, les sulfates, les boros et les boratos sont très.
Les références
- Morrison, R. T. Et Boyd, R, n. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Inter-American.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. (10e édition.). Wiley Plus.
- Wikipédia. (2020). Alkyle. Récupéré de: dans.Wikipédia.org
- Danielle Reid. (2020). Groupe alkyle: définition et aperçu. Étude. Récupéré de: étudier.com
- CHIMISTER BOOLISTexts. (6 avril 2020). Groupes alkyles. Récupéré de: Chem.Bibliothèque.org
- « Normes de coexistence sociale, formes, importance, exemples
- Caractéristiques Voltmètre, fonctionnement, à quoi sert, types »

