Structure d'alcool tertiaire, propriétés, exemples
- 4232
- 553
- Anaïs Julien
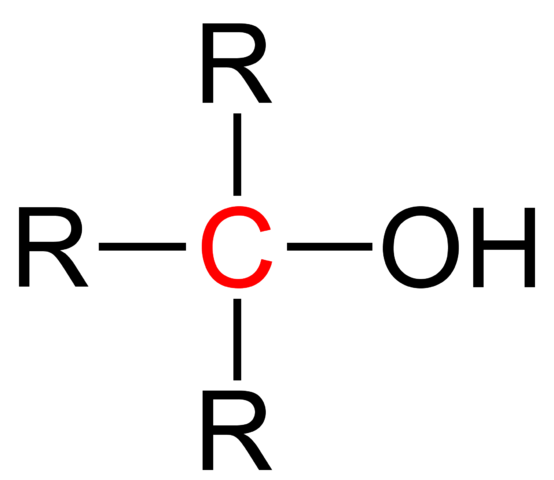
UN Alcool tertiaire C'est celui dans lequel le groupe hydroxyle, OH, est lié à un carbone tertiaire. Sa formule continue d'être ROH, comme d'autres alcools; Mais il est facilement reconnu car oh est proche d'un X dans la structure moléculaire. De plus, sa chaîne gazéifiée est généralement plus courte et sa masse moléculaire majeure.
Ensuite, un alcool tertiaire a tendance à être plus lourd, il est plus ramifié et il est également le moins réactif en ce qui concerne l'oxydation; c'est-à-dire qu'il ne peut pas être transformé en cétone ou acide carboxylique comme se produit avec les alcools secondaires et primaires, respectivement.
 Formule structurelle d'un alcool tertiaire. Source: Jü [domaine public].
Formule structurelle d'un alcool tertiaire. Source: Jü [domaine public]. La formule structurelle générale pour un alcool tertiaire est indiquée dans l'image supérieure. Selon elle, une nouvelle formule de type R pourrait être écrite3COH, où R peut être un groupe alkyle ou aryle; Un groupe de méthilo, ch3, ou une chaîne gazéifiée courte ou longue.
Si les trois groupes R sont différents, le carbone central de l'alcool tertiaire sera chiral; c'est-à-dire que l'alcool présentera une activité optique. Pour ce fait, les alcools étrangers tertiaires facturent l'intérêt dans l'industrie pharmaceutique, car à partir de cétones à activité biologique, ces alcools sont synthétisés avec des structures plus complexes.
[TOC]
Structure d'un alcool tertiaire
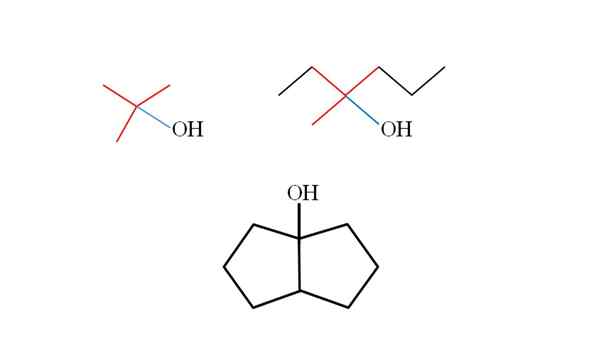 Trois alcools tertiaires et leurs structures. Source: Gabriel Bolívar.
Trois alcools tertiaires et leurs structures. Source: Gabriel Bolívar. Considérez les structures des alcools supérieurs supérieurs pour apprendre à les reconnaître quel que soit le composé. Le carbone lié à OH doit également être lié à trois autres carbones. S'il est observé en détail, les trois alcools respectent ce.
Le premier alcool (à gauche), se compose de trois groupes ch3 Lié au carbone central, dont la formule serait (CHO3)3Coh. Le groupe de location (choisissez3)3C- Il est connu sous le nom de tertbutil.
Il peut vous servir: potentiomètre (phameter)Le deuxième alcool (à droite), a le Central Carbon Lin3, Ch3Ch2 et ch2Ch2Ch3. Comme les trois groupes sont différents, l'alcool est chiral et présente donc une activité optique. Un T n'est pas observé ici, mais un X proche de OH (rouge et bleu).
Et dans le troisième alcool (les couleurs ci-dessous et sans couleurs), l'OH est lié à l'un des deux carbones qui rejoignent deux cyclopentano. Cet alcool ne présente pas d'activité optique car deux des groupes liés au carbone central sont identiques. Comme le deuxième alcool, s'il est soigneusement observé, un X (plutôt un tétraèdre) sera également trouvé.
Encombrement stérique
Les trois alcools supérieurs ont quelque chose de plus en commun qu'un carbone central est empêché par stérologie; c'est-à-dire qu'il y a beaucoup d'atomes qui l'entourent dans l'espace. Une conséquence immédiate de cela est que les nucléophiles, désireux de charges positives, ont des difficultés à aborder ce carbone.
D'un autre côté, ayant trois carbone liés au carbone central, ils donnent une partie de la densité électronique que l'atome électronégatif de l'oxygène le soustait, le stabilisant encore plus devant ces attaques nucléophiles. Cependant, l'alcool tertiaire peut subir une substitution en formant des carbocations.
Propriétés
Physique
Les 3e alcools présentent généralement des structures hautement ramifiées. Une première conséquence de cela est que le groupe OH est évité, et par conséquent, son moment dipolaire exerce un effet mineur sur les molécules voisines.
Cela se traduit par des interactions moléculaires plus faibles par rapport à celles des alcools primaires et secondaires.
Peut vous servir: principe du châtelierPar exemple, considérez les isomères structurels du butanol:
Ch3Ch2Ch2Oh (n-Butanol, PEB = 117ºC)
(Ch3)2Ch2Oh (alcool isobutilique, PEB = 107ºC)
Ch3Ch2Ch (oh) ch3 (Alcool secbutilique, PEB = 98ºC)
(Ch3)3COH (alcool tertbutile, PEB = 82ºC)
Notez comment les points d'ébullition descendent à mesure que l'isomère devient plus ramifié.
Au début, il a été mentionné que dans les structures des alcools 3, un x est observé, ce qui en soi indique une branche élevée. C'est pourquoi ces alcools ont tendance à avoir des points de fusion et / ou d'ébullition inférieurs.
Un peu similaire est le cas pour votre miscibilité avec l'eau. Plus il est empêché que le moins miscible OH soit de l'alcool 3 avec de l'eau. Cependant, cette miscibilité diminue plus la chaîne de carbone est longue; Ainsi, l'alcool thermique est plus soluble et miscible avec l'eau que le n-Butanol.
Acidité
Les alcools tertiaires ont tendance à être les moins acides de tous. Les raisons sont nombreuses et se rapportent les unes aux autres. Dans les comptes sommaires, la charge négative de son alcoxyde dérivé, rouge-, Vous ressentirez une forte répulsion pour les trois groupes alcaux liés au carbone central, affaiblissant l'anion.
Plus l'anion est instable, moins l'acidité de l'alcool sera.
Réactivité
Les alcools ne peuvent pas subir des oxydations en cétones (R2C = o) ou aldéhydos (rcho) ou acides carboxyliques (rcOOH). D'une part, je devrais perdre un ou deux carbones (sous la forme de CO2) oxyder, ce qui diminue sa réactivité contre l'oxydation; Et de l'autre, il manque d'hydrogène qui peut perdre pour former un autre lien avec l'oxygène.
Il peut vous servir: pyridine: structure, propriétés, utilisations, toxicité, synthèseCependant, ils peuvent souffrir de substitution et d'élimination (formation d'une double liaison, d'un alcène ou d'une oléfine).
Nomenclature
La nomenclature de ces alcools n'est pas différente de celle des autres. Il y a des noms communs ou traditionnels, et les noms systématiques régis par l'IUPAC.
Si la chaîne principale et ses ramifications consistent en un groupe de location reconnu, il est utilisé pour son nom traditionnel; Quand il n'est pas possible de le faire, la nomenclature IUPAC est utilisée.
Par exemple, considérez l'alcool tertiaire suivant:
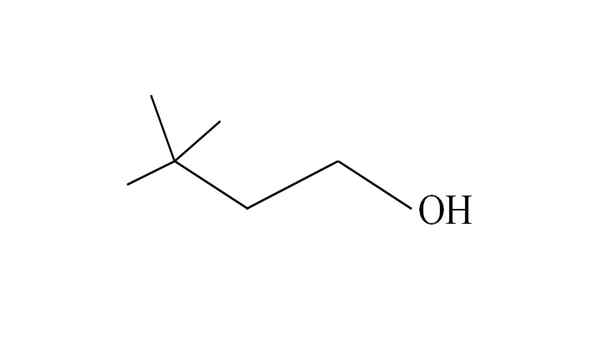 3,3-diméthyl-1-butanol. Source: Gabriel Bolívar.
3,3-diméthyl-1-butanol. Source: Gabriel Bolívar. Il commence à énumérer les carbones de droite à gauche. Dans le C-3, il y a deux groupes ch3 des substituants, et donc le nom de cet alcool est de 3,3-diméthyl-1-butanol (la chaîne principale a quatre carbones).
De même, toute la chaîne et ses ramifications sont constituées du groupe Neohexilo; Par conséquent, son nom traditionnel peut être de l'alcool Neohexyle, ou du néohexanol.
Exemples
Enfin, quelques exemples d'alcools tertiaires sont mentionnés:
-2-méthyl-2-propanol
-3-méthyl-3-hexanol
-BICICLO [3,3,0] octan-1-ol
-2-méthyl-2-butanol: ch3Ch2Coh (ch3)2
Les formules des trois premiers alcools sont représentées dans la première image.
Les références
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Morrison, R. T. Et Boyd, R, n. (1987). Chimie organique. (5e édition). Éditorial Addison-Wesley Inter-American.
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (10e édition.). Wiley Plus.
- Gunawardena Gamini. (31 janvier 2016). Alcool tertiaire. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Ashenhurst James. (16 juin 2010). Alcools (1) - nomenclature et propriétés. Récupéré de: MasterOganicchemistry.com
- Clark J. (2015). Présentation des alcools. Récupéré de: Chemguide.co.ROYAUME-UNI
- Chimie organique. (s.F.). Thème 3. Alcools. [PDF]. Récupéré de: Sinorg.Uji.est
- Nilanjana Majumdar. (3 mars 2019). Synthèse de l'alcool tertiaire chiral: développements significatifs. Récupéré de: 2.Chimie.MSU.Édu
- « Période formative d'origine américaine, caractéristiques, produits
- Comment était la société européenne dans la première moitié du XIXe siècle »

